
Neumol Pediatr 2016; 11 (1): 10 - 14
C o n t e n i d o d i s p o n i b l e e n h t t p : / / www. n e umo l o g i a - p e d i a t r i c a . cl
12
Fibrosis quística y tamizaje neonatal
Algunos laboratorios pueden elegir un valor absoluto de IRT
y otros un porcentaje del valor diario (floating numbers), esto
último evita las variaciones en los resultados por cambios de
temperatura estacionales especialmente cuando el envío de la
muestra al laboratorio puede estar sujeto a demora (14). En
Chile el año 2013 en un plan piloto financiado por el Ministerio
de Salud (MINSAL) se determinó en 3000 muestras de recién
nacidos (RN) con técnica Autodelfia, un valor de corte fijo de
56. 7 (99,5) con especificidad del 99% (15). Bajar el percentil a
95 reduce dramáticamente la especificidad y el valor predictivo
positivo (PPV).
La determinación de IRT se realiza en una gota de
sangre del talón del recién nacido que se coloca en un papel
absorbente en una tarjeta especialmente diseñada (Tarjeta
Guthrie) y se envía a un laboratorio previamente definido y
validado para la técnica implementada.
Dado que los niveles de IRT disminuyen rápidamente
después del nacimiento se recomienda que la muestra de
sangre del talón en el RN sobre 37 semanas de gestación se
deberá tomar entre 48 a 72 hrs. En RN de 36 a 37 semanas de
gestación tomar muestra a los 7 días de edad y RN menor o igual
a 35 semanas de gestación a los 7 días de edad y repetir a los
15 días (16).
Causas de IRT elevado no FQ
Trisomía 13 y 18, stress perinatal, infección congénita,
insuficiencia renal, atresia intestinal, diabetes insípida
nefrogénica (13).
Situaciones especiales
Los pacientes con ileo meconial por razones que no
están claras, frecuentemente tienen IRT normal, es decir pueden
ser falsos negativos y por tanto en todos debe realizarse test del
sudor para confirmar el diagnóstico (13). Debe informarse de
esta situación al laboratorio que realiza tamizaje.
Segundo paso
Existen varias alternativas: IRT, DNA, PAP.
La alta tasa de falsos positivos del primer IRT (superior
al 1%) (19) determina la necesidad de una segunda muestra,
esta puede ser IRT, DNA o PAP. Si la muestra es un segundo IRT
debe tomarse entre las 2 a 3 semanas de nacido, dado que la
disminucion del IRT en niños con FQ disminuye lentamente en
relación al paciente sano (17). Cuando la elección es DNA o PAP
se procesa en la misma primera muestra.
La mayoría de los protocolos están basados en una
combinación de determinación de IRT seguido de análisis
genético con un panel adaptado a la población a estudiar,
incluyendo alelos que presentan las minorías étnicas. Esta última
tecnología ha demostrado alta sensibilidad y especificidad con
alto valor predictivo positivo. Sin embargo países como Chile
en que los resultados positivos en los alelos estudiados en un
panel de 36 mutaciones, revela que las deleciones mayores al
1% son deltaF508 (30.6 %), p.R334W (3.3%), p.G542X (2.4%),
c.3849+10Kb CNT(1.3%) p.R553X (1.2%) (18), acompañado de
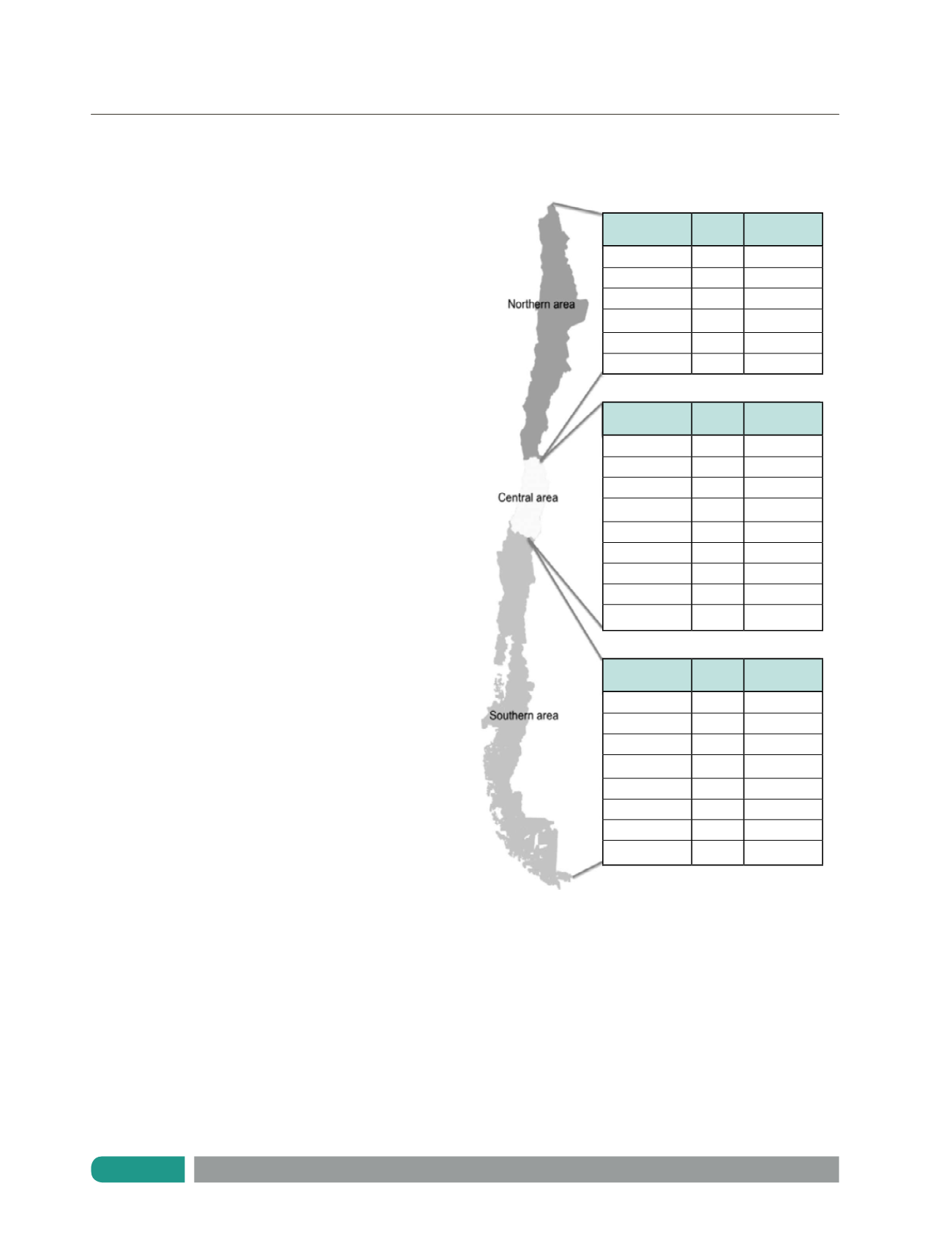
gran heterogeneidad geográfica (Figura 2). Esto determina que
el protocolo a seguir en nuestro pais deberá ser IRT/IRT o IRT/
PAP.
Algunos problemas de IRT/DNA (13)
- Aumento de portadores sanos determina altos índices de
ansiedad en los padres, depresión, disminución del apego al
recién nacido y la apreciación de tener un niño sano pero “no
tan sano “, lo que hace fundamental el seguimiento y apoyo, lo
cual implica una infraestructura adicional de ayuda a la familia.
- Aumenta el número de niños con diagnóstico no concluyente
definidos como “Síndrome metabólico relacionado al CFTR”
(CRMS) en Estados Unidos y como “Diagnóstico tamizaje
neonatal FQ no concluyente”, en Europa, los cuales deberán ser
referidos al especialista en FQ. Los test ambiguos, en algunos
casos se deben a una variante de FQ que más adelante presenta
Figura 2.
Distribución de mutaciones en Chile (18)
Protocolo
Alleles
detected
Allele
frequency (%)
Unknown
28
46.7
p.F508del
27
45.0
p.R553X
3
5.0
c.3849+10Kb G>T
1
1.7
c.3120+1 G>A
1
1.7
Total
60
100
Mutation
Allele
detected
Allele
frequency (%)
Unknown
219
57.6
p.F508del
110
28.9
p.R334W
14
3.7
p.G542X
13
3.4
c.3849+10Kb G>T
9
2.4
p.R553X
3
0.8
p.1162X
2
0.5
Other
10
2.6
Total
380
100
Mutation
Allele
detected
Allele
frequency (%)
Unknown
88
63.8
p.F508del
40
29.0
p.R334W
4
2.9
p.1162X
3
2.2
p.G542X
1
0.7
p.R553X
1
0.7
P.G85E
1
0.7
Total
138
100
















