Activador AICAR
Píldora deportiva... podría ser
Los deportes de resistencia activan el programa de remodelación del músculo esquelético aumentando progresivamente el rendimiento de los atletas tales como corredores de maratón, montañistas y ciclistas. Esto implica cambios en los procesos metabólicos y en las proteínas estructurales dentro de las miofribas, alterando la utilización del sustrato energético y las propiedades contráctiles que interactúan para reducir la fatiga muscular.
Teniendo en cuenta los numerosos beneficios del ejercicio sobre la salud, la identificación de agentes activos por vía oral que imiten o potencien los efectos genéticos de los deportes de resistencia ha sido un trabajo de larga data, aunque difícil de alcanzar es un deseado objetivo médico. Por ejemplo, se ha visto que altas dosis de ciertos extractos naturales tales como resveratrol pueden mejorar la resistencia. Sus efectos aeróbicos dependen de la activación del complejo coactivator SIRT1-PGC1alfa en el músculo esquelético, sin embargo, sus efectos finales en humanos se desconocen.
En conjunto, todos estos conocimientos y resultados podrían ofrecen nuevas perspectivas farmacológicas respecto al rendimiento muscular y al manejo de enfermedades metabólicas.
Ejercicios de resistencia, GW1516, PPAR y AMPK
El ejercicio físico regular tiene indiscutibles beneficios para la salud, como la prevención - y en algunos casos, el tratamiento - de muchas enfermedades. El problema es que para la gran mayoría de las personas, probablemente un 70% de la población, hay una incapacidad o falta de voluntad para cumplir con el mínimo de actividad física establecido por las instituciones sanitarias. La idea de tomar una pastilla para obtener los dividendos del ejercicio es extremadamente atractiva para millones de sedentarios. Un reciente estudio realizado por Vihang A. Narkar y colaboradores (Cell 2008; 134:405-415.) sugiere que un par de moléculas podrían imitar algunos efectos del ejercicio físico.
El músculo esquelético es un tejido extraordinario, fundamental no sólo para el movimiento, sino que también para el control de la homeostasis metabólica del organismo. Se compone de diferentes tipos de células alargadas y multinucleadas llamadas miofibras. Las del tipo I tienen una velocidad de contracción lenta, son extremadamente oxidativas y poseen un aspecto rojizo. Las miofibras tipo II tienen un velocidad más rápida de contracción, con propiedades metabólicas glicolíticas y oxidativas, y son bastante más blancas en apariencia.
El músculo esquelético es altamente adaptable, o plástico, en donde los ejercicios provocan cambios en el metabolismo y en las propiedades contráctiles de las miofibras. En las pruebas aeróbicas, como correr y nadar, las miofibras adquieren un fenotipo lento, con aumento en los niveles de las enzimas oxidativas, glucógeno y del transportador de glucosa tipo 4 (GLUT4), la proteína que transporta la glucosa en el músculo. Estos cambios están acompañados por un incremento en la sensibilidad a la insulina muscular y una mejora general en la homeostasis de la glucosa en el cuerpo. Cuando un roedor o humano está inactivo, un cierto número de miofibras pueden convertirse en un fenotipo rápido, lo que las hace menos capaces de realizar trabajo aeróbico sostenido contribuyendo a un estado de resistencia a la insulina.
Las investigaciones han sugerido un papel para el receptor de peroxisoma-proliferador-activado delta (PPAR-delta) y la proteína quinasa activada por AMP en la regulación del metabolismo y de las características contráctiles de las miofibras. Las proteínas PPAR son receptores nucleares que funcionan como factores de transcripción y regulan la expresión de múltiples genes. A la proteína quinasa activada por AMP se le describe como un regulador metabólico maestro. Aquí intervienen muchos genes controladores de la expresión que realizan su función a través de la fosforilación de proteínas nucleares. El grupo de Narkar planteó la hipótesis de que PPAR-delta y la proteína quinasa activada por AMP pueden interactuar para controlar el fenotipo metabólico de las miofibras. De hecho, sus hallazgos sugieren que la proteína quinasa es parte de un complejo transcripcional con PPAR-delta, y ellos especularon que la quinasa, directa o indirectamente, potencia la actividad del receptor.
Los autores descubrieron que la administración del agonista GW1516 para PPAR-delta a ratones sedentarios durante 4 semanas provocó un aumento significativo en la expresión de genes oxidativos en los músculos, pero no aumentó la conversión de las fibras de contracción lenta de tipo I o el tiempo o distancia recorrida por los animales en las pruebas de resistencia (figura 1). Sin embargo, cuando GW1516 fue dado simultáneamente con ejercicios sobre un tapiz rodante durante 4 semanas, se produjo la transformación de las fibras tipo I y aumentos de resistencia cercanos al 70% con respecto a lo observado en el grupo control de ratones. Cuando los autores trataron a animales sedentarios con un activador de la proteína quinasa activada por AMP llamado AICAR (5-aminoimidazol-4-carboxamida-1-beta-4-ribofuranosida), se observó una mejora en el rendimiento del ejercicio en un 44% más que en los controles, simulando los efectos de la actividad física. Estos resultados son consistentes con estudios anteriores que habían señalado que sólo 5 días de tratamiento con AICAR aumenta los niveles de glucógeno, GLUT4 y de enzimas mitocondriales en los músculos esqueléticos de rata, y eleva la actividad de la proteína quinasa activada por AMP por medio de la manipulación genética generando mayor rendimiento en los ejercicios de resistencia y en las enzimas mitocondriales. Otros estudios han demostrado que AICAR puede aumentar la absorción de glucosa en el músculo, la disminución de los niveles de glucosa en la sangre, e incluso disminuir la adiposidad.
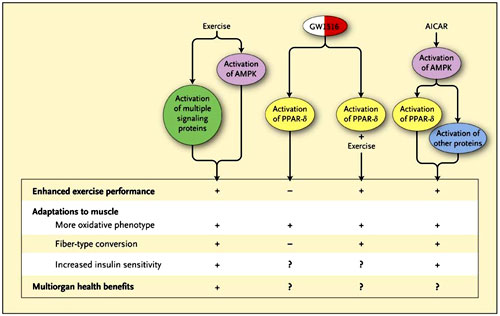
El estudio realizado por Vihang A. Narkar y colegas sugiere que dos agentes, GW1516 y AICAR (5-aminoimidazol-4-carboxamida-1-beta-4-ribofuranosida), agonistas de la proliferación del receptor de peroxisoma-proliferador-activado delta (PPAR-delta) y de la proteína quinasa activada por AMP (AMPK), respectivamente, pueden imitar algunos de los efectos beneficiosos del ejercicio en el músculo esquelético. Los autores demuestran que las señalizaciones de AMPK y PPAR-delta interactúan, dando lugar a muchas adaptaciones en el músculo esquelético. Otras investigaciones han concluido que el ejercicio aeróbico activa a AMPK y a otras vías de señalización en el músculo esquelético, generando un fenotipo más oxidativo y sensible a la insulina, similar al ejercicio, con numerosos efectos positivos sobre los órganos del cuerpo.
Como AICAR mejora la función muscular, ¿podría convertirse en elección de dopaje para los deportistas? ¿Podemos curar la obesidad y la diabetes tipo 2 con su uso u con otros agonistas de la proteína quinasa activada por AMP? No del todo. Hay muchos factores a considerar. Por una parte, la AMPK es un complejo de proteínas, un heterotrímero compuesto de una subunidad catalítica alfa y de las subunidades reguladoras beta y gamma. Cada subunidad tiene múltiples isoformas, y se han descrito 12 complejos de la proteína quinasa activada por AMP que varían según distribución en los tejidos y la sensibilidad a los agentes de activación.
AICAR es un agente regulador de la adenosina que aumenta la biodisponibilidad del nucleósido. Como tal, se ha estudiado extensamente en pacientes con isquemia miocárdica y durante la cirugía de revascularización cardíaca, mejorando los resultados cardiovasculares. Sin embargo, tiene una vida media corta tras la administración intravenosa y una mala biodisponibilidad después de la ingestión oral, además, se acompaña de un aumento en los niveles sanguíneos de ácido láctico y ácido úrico, por lo que es pobre candidato para el uso a largo plazo. La búsqueda de nuevos compuestos que estimulen la proteína quinasa activada por AMP continúa, pero con ciertos cuidados: hay mutaciones naturales que ocurren en el gen codificante de la subunidad gamma2 de la AMPK (expresada en el corazón) que se traducen en la activación de la quinasa y se asocia con la preexcitation ventricular e hipertrófica miocardiopatía. Por otra parte, también se ha observado que la proteína quinasa activada por AMP participa en la regulación de la apoptosis; su activación podría tener efectos no deseados sobre la proliferación celular. En el hipotálamo, la activación de la proteína quinasa activada por AMP puede aumentar el consumo de alimentos, lo que sería indeseable en personas con obesidad y diabetes tipo 2.
Precisamente estas complejidades han inhibido a las empresas farmacéuticas que han estado trabajando en el desarrollo de activadores de la proteína quinasa activada por AMP en la última década. Pero los recientes resultados han demostrado que tales activadores pueden tener efectos específicos a las isoformas han cimentado las esperanzas de que un activador de la AMPK se pueda desarrollar en el futuro.
Existe un consenso general entre los científicos que han analizado el músculo esquelético: los agentes, como AICAR, que estimulan la proteína quinasa activada por AMP pueden llegar a ser útiles en el tratamiento de la obesidad y la diabetes. Esto podría ser especialmente importante en pacientes que no pueden realizar ejercicios a causa de graves trastornos musculoesqueléticos o condiciones cardiovasculares. Sin embargo, los agonistas de la proteína quinasa activada por AMP sólo podrían ser beneficiosos en la imitación de algunos de los efectos del ejercicio aeróbico, ya que la contratación muscular esquelética provocan una serie de señales metabólicas y mecánicas que contribuyen a la adaptación del músculo (figura 1). Ahora sabemos que el ejercicio regular tiene efectos profundamente positivos en casi todos los órganos del cuerpo. Es poco probable que una "píldora del ejercicio" reemplace los beneficios del deporte regular. Mientras tanto, el sofá seguirá siendo más cómodo todavía.
Fuente bibliográfica
The Exercise Pill — Too Good to Be True?
Laurie J. Goodyear, Ph.D.
Joslin Diabetes Center and Harvard Medical School, Boston, USA.
N Engl J Med. 2008 Oct 23;359(17):1842-4