Una cura para el resfriado común
El rinovirus humano (RVH), el agente del resfriado común, es responsable del 50% de las exacerbaciones asmáticas y es uno de los factores que pueden dirigir el sistema inmunológico infantil hacia un fenotipo asmático. Se clasifican según uso de la molécula de adhesión intercelular-1 (ICAM-1) o del receptor de lipoproteínas de baja densidad (LDLR) en la invasión celular. Las secuencias parciales de las regiones codificantes para la cápsida y de un número limitado de genomas completos el virus se ha organizado en 99 cepas y dos especies: RVH-A (que contiene 74 serotipos) y RVH-B (con 25 serotipos).
Recientemente, un número desconocido de rinovirus humano han sido detectados en pacientes con enfermedades similares a la gripe asociadas con compromiso respiratorio severo. Estos no han podido ser cultivados, pero sus secuencias indican que probablemente representen a una tercera especie (HRV-C). La falta de secuencias genómicas completas ha hecho difícil la compresión molecular y las características evolutivas del virus, pero también ha obstaculizado la investigación epidemiológica de las infecciones del tracto respiratorio superior y las epidemias de asma.
Descifrando el código genético del rinovirus
El rinovirus humano es responsable del 50 al 80% de los resfriados comunes y, por tanto, causa pobreza, morbilidad, disminución de la productividad, uso inadecuado de antibióticos y costos económicos estimados en más de 60 mil millones de dólares cada año sólo en los Estados Unidos. En niños muy pequeños, adultos mayores y en personas con inmunodeficiencia, el RVH también puede provocar una grave enfermedad del tracto respiratorio inferior.
Los rinovirus humanos se descubrieron en la década de 1950, pertenecen a la familia Picornaviridae, con un único filamento de ARN de longitud en sentido positivo. Ceca de 100 serotipos han sido identificados y diferenciados por análisis serológicos o secuencias parciales de la cápsida viral. Aunque las primeras secuenciaciones señalaron algunas ideas de sus características biológicas, los vacíos y espacios en las secuencias han limitado nuestra comprensión de la evolución y las características moleculares de los virus, y de las relaciones entre variantes virales, epidemiología y el espectro de las infecciones respiratorias y las epidemias.
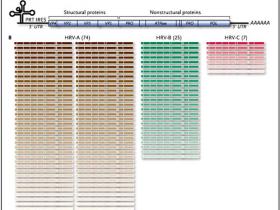
Una reciente publicación de Ann C. Palmenberg y colegas (Science. 2009 Apr 3; 324(5923):55-9) ha permitido conocer más detalles sobre el RVH a través de la secuenciación completa de los genomas de 99 serotipos víricos (figura 1). Al comparar estas secuencias, los investigadores identificaron lugares altamente conservados en regiones consideradas importantes para la síntesis de ARN, la replicación viral, y la traducción del genoma viral en proteínas. Estas zonas podrían representar posibles objetivos para el desarrollo de antivirales, por ejemplo, como sitios de entrada al ribosoma.

El estudio realizado por Ann Palmenberg y colaboradores reveló una sorprendente diversidad genética entre los rinovirus humanos. En el panel A se muestra la organización de la estructura general del genoma para todas las clases. Las cajas azules señalan regiones codificantes de proteínas que podrían ser objetivos para el desarrollo de fármacos y vacunas. También se detallan las regiones 5’ y 3’ no traducidas (UTRs). La estructura en trébol es común en todos los rinovirus humanos. El panel B muestra una representación esquemática de las subfamilias A, B y C. La variación de secuencia entre los genomas está representada por diferentes tonos y colores. AAAAAA denota poliadenilación, PRT zonas ricas en pirimidina y IRES el sitio de entrada al ribosoma.
El trabajo del grupo de Palmenberg también identificó un segmento rico en pirimidinas que mostró una sorprendente variación entre especies del RVH y entre cepas del mismo serotipo. En otros picornavirus (por ejemplo, poliovirus, cardiovirus y aftovirus), esta localización genómica parece tener un potencial patológico. Si este segmento rico en pirimidinas tiene una función análoga en los RVH, su variación de secuencia será útil en la comprensión de la epidemiología molecular y en la asociación entre la enfermedad fenotípica y el genotipo del virus.
Los investigadores también observaron una evidencia filogenética para el tipo RVH-C (que nunca ha sido cultivado) y una división dentro de RVH-A que es lo suficientemente grande para sugerir una nueva forma de RVH. Se obtuvo información de que la recombinación entre subfamilias de RVH se produce durante la coinfección, permitiendo una considerable divergencia de secuencia que podría dar lugar a una progenie con diferentes características biológicas y patógenas. Además, los autores describen un sorprendente grado de variación en aislados víricos de lavado nasal en pacientes con infecciones por RVH, incluso dentro del mismo serotipo, proporcionando una posible explicación de la pobre eficacia terapéutica observada en ensayos clínicos con antivirales para el tratamiento de la infección.
La identificación de genomas muy divergentes entre cepas, la coinfección con diferentes cepas, los eventos de recombinación, y la identificación de nuevas formas de RVH y de regiones altamente conservadas (y por lo tanto posibles epítopos) que pueden conferir la virulencia de la enfermedad, ofrecen nuevas oportunidades para el desarrollo racional y dirigido de medicamentos y vacunas. Existen varios enfoques para la elaboración de una vacuna que vale la pena considerar. Estos incluyen el uso de virus vivos atenuados o de proteínas recombinantes, vacunas a base de genes, y anticuerpos monoclonales dirigidos a epítopos virales. Además, los nuevos enfoques implementados podrían permitir la ocultación de epítopos inmunodominantes y la consiguiente reorientación de la adaptación del sistema inmune hacia un estado altamente conservado.
El patrón de desarrollo de una vacuna para el RVH como el de la vacuna antigripal trivalente también podría ser útil. Esto implicaría el desarrollo de vacunas multivalentes contra cepas o formas RVH que proporcionarían protección cruzada entre cepas o formas relacionadas. Tal enfoque sería probablemente más eficaz cada año con el uso de la base de datos genómica surgida del trabajo de Palmenberg y colaegas.
Debido a que el rinovirus humano ataca la mucosa de las vías respiratorias superiores, por lo general la patogenicidad comparativa es baja y con una amplia diversidad antigénica, los virus podrían ser utilizados como vectores para crear vacunas o terapias contra otras enfermedades. Es estudio sugiere que los rápidos avances en la secuenciación y la tecnología bioinformática facilitará enfoques creativos para el desarrollo de vacunas y medicamentos antivirales.
Fuente bibliográfica
Common Cold, Uncommon Variation
Gregory A. Poland, M.D., and Michael A. Barry, Ph.D.
Department of Medicine, Mayo Clinic, Rochester, MN, USA.
N Engl J Med. 2009 May 21; 360(21):2245-6