Células madre para investigar el desarrollo humano
Recientemente se ha logrado derivar células madre con potencial expandido(EPSC) desde blastomeros de ratones mediante la inhibición de las vías moleculares críticas que predisponen su diferenciación. Las EPSC enriquecen las firmas moleculares de los blastómeros y poseen la potencia de desarrollo para todos los linajes celulares embrionarios y extraembrionarios. En un estudio liderado por investigadores de la Universidad de Hong Kong (China), se reporta la derivación de EPSC porcinas, que expresan genes clave de pluripotencia, que son genéticamente estables, permiten la edición del genoma, se diferencian en derivados de las tres capas germinales en quimeras y producen células primordiales tipo germinales in vitro. En condiciones similares, las células madre embrionarias humanas y las pluripotentes inducidas pueden ser convertidas, o las células somáticas reprogramadas directamente, en EPSC que muestren los atributos moleculares y funcionales de EPSC porcinas. Las células madre tipo trofoblásticas pueden ser generadas a partir de EPSC humanas y porcinas. Estos hallazgos muestran que es posible generar células madre pluripotentes de mamíferos, y que las EPSC presentan una plataforma celular única para la investigación traslacional en biotecnología y medicina regenerativa.
Potencial expandido
Las células madre pluripotentes -que tienen la capacidad de diferenciarse en cualquier tipo celular del organismo- tienen un enorme potencial para la medicina regenerativa y para revelar la biología del desarrollo que subyace a la salud y a las enfermedades. Los nuevos avances en las tecnologías de células madre son cruciales para comprender las primeras etapas del desarrollo de la placenta, un período crítico para el éxito del embarazo. Si el trofetódermo, la cáscara externa del blastocisto, no logra expandirse, diferenciarse o interactuar con el revestimiento uterino, no habrá embarazo; la infertilidad a menudo se debe a la pérdida del conceptus en esta etapa. Las interrupciones menos severas de la placentación temprana pueden permitir la implantación, pero conducen a un aborto espontáneo. Finalmente, la placentación que puede apoyar un embarazo completo, pero no de manera óptima, puede resultar en trastornos comunes y a menudo devastadores del embarazo, como la restricción del crecimiento intrauterino, la preeclampsia y el parto prematuro.
Desafortunadamente, la disponibilidad de material placentario desde el primer trimestre del embarazo es limitada. La placenta es esencialmente inaccesible para los investigadores desde aproximadamente una semana después de la concepción hasta la detección más temprana posible del embarazo, entre las segunda y tercera semana después de la concepción. Los estudios en animales han demostrado que existen vías conservadas de desarrollo de la placenta, pero la enorme diversidad de placentas de mamíferos las hace insuficientes para proporcionar una comprensión completa de la placenta humana. La mayor parte de lo que sabemos sobre su desarrollo en humanos proviene de un puñado de especímenes archivados desde la década de 1930 hasta la de 1960, alojados en la colección Carnegie en Washington, D.C., y en la colección Boyd en Cambridge, Reino Unido.
Los tipos de células madre previamente descritas, como las células madre embrionarias (CME), pueden utilizarse para abordar la falta de muestras tempranas de placenta mediante la recapitulación de muchos aspectos de la diferenciación de las células trofoblásticas placentarias (figura 1). Las CME humanas cebadas se derivan de células que forman parte de la masa celular interna del blastocisto, llamada epiblasto. Por lo tanto, se derivan de células que ya se han separado del linaje trofeodérmico, y no se diferencian espontáneamente en trofoblastos en los teratomas. Sin embargo, en el tratamiento con BAP (factor de crecimiento morfogenético ósea 4 [BMP4] más los inhibidores de señalización A083-01 y PD173074), estas CME se diferencian eficientemente en células de tipo trofoblástico placentario.
Este sistema tiene sus inconvenientes. Una vez que los CME se han diferenciado terminalmente en trofoblastos, ya no pueden propagarse. Por lo tanto, deben diferenciarse en células tipo trofoblasto para cada experimento a corto plazo. Además, aunque las células resultantes son uniformemente trofoblásticas, contienen una mezcla de subtipos de trofoblastos, lo que dificulta el estudio de linajes específicos de trofoblastos. El tratamiento a corto plazo (24 horas) de las CME con BAP conduce a una población estable de células ("células cebadas con BAP") que pueden diferenciarse espontáneamente en trofoblastos, así como en los tres linajes embrionarios (en el contexto de teratomas inducidos) y pueden ser dirigidas hacia la diferenciación en sublinajes específicos de trofoblastos. Sin embargo, no pueden ser mantenidas, in vitro, como trofoblastos. Recientemente, se logró crear células madre de trofoblastos humanos a partir de células trofoblásticas de blastocitos, así como de trofoblastos placentarios del primer trimestre.
A diferencia de las células trofoblásticas derivadas de CME, las células troncales trofoblásticas pueden propagarse, y la diferenciación en subtipos particulares de trofoblastos puede efectuarse mediante el cultivo en presencia de factores específicos. Las células madre trofoblásticas y las CME comparten el inconveniente de requerir la derivación de los tejidos del conceptus, lo que plantea preocupaciones éticas para algunos. El uso de estos tejidos también plantea incertidumbres políticas y regulatorias. Las células madre pluripotentes inducidas (CMPi) se crean reprogramando células adultas mediante su transductor con cuatro a seis genes de "pluripotencia ", pero las CMPi tienen el mismo potencial de diferenciación de trofoblastos que las CME y, de forma similar, las células tipo trofoblastos derivadas de ellas no pueden propagarse.
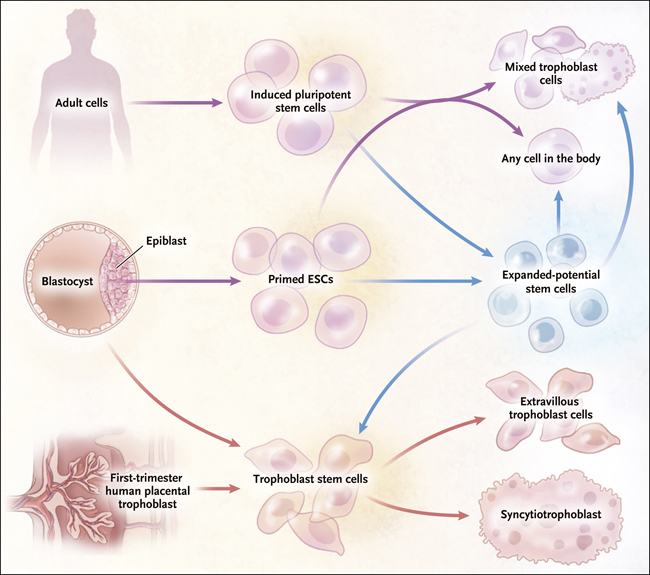
Figura 1. Fuente y potencial de células madre.
Las fuentes y capacidades de diferenciación de las células madre de potencial expandido, recientemente reportadas por Gao y colaboradores (DOI: 10.1038/s41556-019-0333-2) se muestran en comparación con las de las células madre embrionarias (CME), las células madre pluripotentes inducidas (CMPi) y las células madre trofoblásticas. Las CME humanas se derivan de la masa celular interna del blastocisto, y las iPSC se derivan de una amplia gama de células somáticas (flechas púrpuras). Comparten amplias características moleculares y celulares, así como una morfología similar en cultivo. Las CME y las CMPi se diferencian en una mezcla de subtipos de trofoblastos cuando se exponen a BAP (proteína morfogenética ósea 4 [BMP4] más los inhibidores de señalización A083-01 y PD173074) y tienen la capacidad de diferenciarse en cualquier tipo de célula embrionaria (pluripotencia). Las células madre de los trofoblastos humanos se derivan de las células trofoblásticas de los blastocitos o de las vellosidades placentarias del primer trimestre (flechas rojas). Las células madre trofoblásticas pueden autorrenovarse y pueden ser dirigidas hacia cualquiera de los principales subtipos de trofoblastos de la placenta (trofoblasto extravelloso y sincitiotrofoblasto) al exponerse a condiciones de cultivo definidas. Al cambiar la señalización celular (flechas azules), las CME y las CMPi pueden convertirse en células madre de potencial expandido, que conservan la capacidad de diferenciarse de cualquier linaje embrionario, así como en células trofoblásticas (en caso de exposición a BAP). Sin embargo, son únicas en el sentido de que pueden convertirse en células madre trofoblásticas.
Xuefei Gao y sus colaboradores (DOI: 10.1038/s41556-019-0333-2) han reportado recientemente un nuevo tipo de célula madre: la célula madre con potencial expandido, que combina las ventajas de los otros tipos de células madre (figura 1). Después de examinar 400 combinaciones de 20 factores, los investigadores llegaron a un nuevo cóctel que, cuando se añade a las CME o a las CMPi, produce cultivos estables de células madre con potencial expandido que pueden diferenciarse eficientemente en trofoblastos, y algunas líneas pueden convertirse en células madre de trofoblastos, algo que no se había logrado con otros tipos celulares. En consecuencia, las CMPi (que pueden obtenerse sin el uso del tejido conceptus) pueden convertirse en células madre con potencial expandido y luego en células madre trofoblásticas, que pueden ser mantenidas muchos pasajes. Anteriormente, las células madre trofoblásticas podían obtenerse sólo a partir del tejido placentario del primer trimestre, cuando las condiciones clave de la disfunción trofoblástica como la preeclampsia, la restricción del crecimiento y los signos asociados con el nacimiento prematuro no son aparentes. El método descrito por Gao y sus colegas hace posible recolectar células después del parto de un embarazo complicado, convertirlas en CMPi, y luego, en células madre con potencial expandido que pueden ser diferenciadas en líneas estables de células madre trofoblásticas para modelar enfermedades de la placenta.
Los investigadores también reportan la derivación de células madre de potencial expandido a partir de células madre porcinas y blastocitos. Los cerdos ofrecen una serie de ventajas como modelo para la salud humana, incluidas sus similitudes en cuanto al tamaño corporal y el sistema inmunitario, así como su vida útil, que es larga en comparación con la de los roedores. Estas características permiten probar las técnicas quirúrgicas humanas y los métodos de imagen. Ellos hacen que los cerdos sean muy adecuados para la realización de pruebas de trasplantes personalizados de células u órganos derivados de líneas de CMPi autólogas, un objetivo importante de la medicina regenerativa. La ingeniería de células madre pluripotentes expandidas porcinas reportada por Gao y sus colegas representa un paso importante en la superación de dificultades de larga data en el establecimiento de células madre pluripotentes porcinas auténticas; estas dificultades han incluido la expresión continua de los genes de pluripotencia exógena, la expresión deficiente de los genes de pluripotencia endógena y la capacidad limitada para diferenciarse.
Este desarrollo de nuevos métodos de células madre que evitan el uso de células derivadas de embriones y permiten al mismo tiempo la investigación en biología del desarrollo y en medicina regenerativa y personalizada, es particularmente bienvenido en vista de los continuos desafíos éticos, políticos y regulatorios en el campo de las células madre.
Fuente bibliográfica
Modeling the Placenta with Stem Cells
Toshihiko Ezashi, Ph.D., Danny J. Schust, M.D., and Laura C. Schulz, Ph.D.
Division of Animal Sciences (T.E.) and the Department of Obstetrics, Gynecology and Women's Health (D.J.S., L.C.S.), University of Missouri, Columbia.
NEJMcibr1907773