Deleción génica para promover la nefrogénesis
La nefrogénesis concluye en la semana 36 de gestación en humanos y en el tercer día de vida postnatal en ratones. Extender el período nefrogénico puede reducir la aparición de enfermedades renales y cardiovasculares en adultos asociadas con números bajos de nefronas. En un reciente estudio en ratones, se eliminó condicionalmente Mtor o Tsc1 en las células progenitoras renales. La pérdida de un alelo de Tsc1 causó una reducción en el número de nefronas; la deleción completa condujo a una escasez severa de glomérulos en el riñón que resultó en la muerte temprana después del nacimiento. Por el contrario, la pérdida de solo un alelo Tsc1 de los progenitores renales resultó en un aumento del 25% en la dotación de nefronas sin efectos adversos. Tal hallazgo podría ser el inicio de nuevos enfoques experimentales para proteger a bebés en riesgo y quizás para tratar la enfermedad renal en niños y adultos
Hamartina
El riñón de los mamíferos, además de filtrar y eliminar los desechos de la sangre (y por lo tanto producir orina), regula la presión arterial, los fluidos corporales, sales y minerales y produce hormonas que regulan la eritropoyesis y otros procesos. El desarrollo de los riñones metanéfricos se completa al final de la gestación, aproximadamente a las 34 a 36 semanas en humanos y hasta varios días tras el nacimiento en ratones. El riñón humano completamente formado tiene un promedio de aproximadamente 1 millón de nefronas, cada una de las cuales consiste en una unidad de filtración (el glomérulo), un tubo complejo que contiene segmentos especializados (el túbulo proximal, el asa de Henle y el túbulo distal) y un conducto colector.
El número total de nefronas disminuye gradualmente a lo largo de la vida. Sorprendentemente, hay una gran variación en su número - de aproximadamente 200.000 a más de 2,5 millones por riñón en humanos. Se dice que las personas con menos nefronas tienen una "baja dotación", y una evidencia sustancial indica que dichas personas están en mayor riesgo de padecer enfermedad renal crónica e hipertensión a través de varios mecanismos. Actualmente se cree que una persona con una baja dotación de nefronas desde el nacimiento puede tener una tasa de filtración glomerular relativamente alta por nefrona - hiperfiltración - desde los primeros años de vida y, por lo tanto, sería especialmente susceptible al daño renal y sufriría pérdida de nefronas cuando se expone a factores estresantes como nefrotoxinas, infecciones, diabetes o cambios en la perfusión intrarrenal.
No existe ningún medio conocido por el cual las nefronas gravemente dañadas puedan regenerarse ni ningún medio de inducir nuevas nefronas para compensar las pérdidas o la función comprometida de las nefronas existentes. El desarrollo de un medio para mantener la función renal o evitar una baja dotación de nefronas revolucionaría la atención y los resultados clínicos. En consecuencia, un objetivo valioso es obtener la capacidad de reactivar la nefrogénesis después de una lesión renal (independientemente de la etapa de la vida) o prolongar la nefrogénesis en los recién nacidos en riesgo, como los que son pequeños para la edad gestacional o prematuros. Por lo tanto, se acoge con satisfacción un estudio sobre la regulación de la nefrogénesis, del que han informado recientemente Volovelsky y sus colaboradores (DOI: 10.1073/pnas.1712955115).
La nefrogénesis es compleja. La nefrona está compuesta de al menos 14 tipos de células distintas, y su desarrollo está mediado por la acción de muchos genes. Durante la nefrogénesis, una serie iterativa de procesos de señalización entre el divertículo metanefrogénico y el mesénquima "cap" circundante dan lugar a ramificaciones y ondas sucesivas de formación de nefronas. Estos procesos de señalización apoyan una transición mesenquimal a epitelial y culminan en la salida de la célula progenitora de nefrón del nicho nefrogénico y la participación de la célula en la formación de nefrón (figura 1). Dentro del nicho, las células progenitoras se replican, lo que es un factor determinante del número de nefronas que se forman posteriormente. Una estrategia para aumentar la dotación de nefronas es aumentar el número de células progenitoras que se replican dentro del nicho. Un estudio previo de Chen y colaboradores (DOI: 10.1016/j.devcel.2015.09.009) estableció que las células progenitoras que residen en nichos tienen una duración de vida variable, y que las células más antiguas tienen más probabilidades de salir del nicho que las más jóvenes. (las células más viejas pueden distinguirse molecularmente de las progenitoras más jóvenes por el mayor número de componentes ribosomales y otras características.) Un hallazgo fundamental de ese estudio es que tanto la vida útil de las células progenitoras de nefronas dentro del nicho como su tasa de salida del nicho pueden ser reguladas. Por ejemplo, una disminución en un factor de crecimiento específico (por ejemplo, el factor de crecimiento de fibroblastos 20) estimula un aumento en las tasas de salida del nicho.
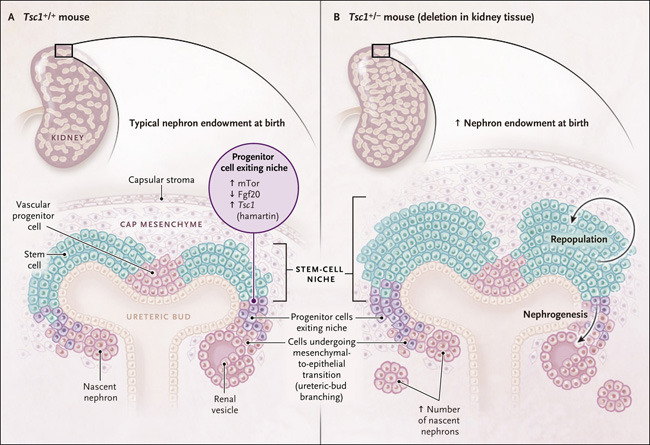
Figura 1. Ajustar la nefrogénesis para aumentar los números de nefronas.
Durante el desarrollo, las células progenitoras nefrogénicas salen del nicho entre el divertículo metanefrogénico y el mesénquima "cap" y se diferencian en las células que componen la nefrona. Dentro del nicho, proliferan; las células más viejas son más propensas que las más jóvenes a salir del nicho. Estudios recientes, como el de Volovelskyy colegas (DOI: 10.1073/pnas.1712955115) han dilucidado las señales moleculares que inducen la retención de células dentro del nicho. Una de estas señales es producida por hamartina, una proteína codificada por Tsc1 (que tiene variantes patogénicas que causan esclerosis tuberosa). Estos investigadores mostraron que la supresión génica de la hamartina resultó en un aumento en el número de nefronas en ratones. El panel A muestra el nicho de un ratón con Tsc1 intacto, y el panel B el nicho de un ratón con eliminación heterocigótica de Tsc1 en el tejido renal. Fgf20 denota el factor de crecimiento de fibroblastos 20, y mTor la diana de rapamicina en células de mamífero, una proteína quinasa.
A pesar del dogma de que las nefronas no son regenerativas, cada vez hay más pruebas de que las células epiteliales renales, una vez lesionadas, pueden volver a estados indiferenciados y proliferar, y que bajo ciertas condiciones las células progenitoras locales pueden activarse y proliferar. Aunque no se ha demostrado la regeneración real de la nefrona, el descubrimiento de que las primeras etapas de la nefrogénesis pueden ser reguladas por señales específicas es pertinente para el objetivo de la regeneración terapéutica de la nefrona.
El efecto negativo de un factor estresante ambiental (inanición) en el número de nefronas está regulado por la proteína mTor en ratas, y Volovelsky y sus colegas notaron un aumento en los niveles de mTor y hamartina a medida que la diferenciación disminuye y la nefrogénesis cesa. Observando, además, que hamartina, al formar un complejo con la proteína TSC2 (es decir, el complejo TSC), inhibe a mTor, se planteó la hipótesis de que la supresión genética de hamartina permitiría la nefrogénesis. Por lo tanto, eliminaron condicionalmente Mtor, que codifica mTor, y Tsc1, que codifica hamartina, uno a la vez, y examinaron los efectos sobre la nefrogénesis en ratones. La eliminación de Mtor llevó a un número considerablemente menor de nefronas y causó edema. La eliminación de ambas copias de Tsc1 condujo a un fenotipo letal con riñones marcadamente aberrantes. Pero cuando los autores eliminaron sólo un alelo de Tsc1, observaron una nefrogénesis ligeramente prolongada, que implicaba un aumento de las células progenitoras de nefronas dentro del nicho y resultó en un aumento del 25% en la dotación de nefronas. No observaron efectos adversos aparentes. Además, los ensayos in vitro otorgaron datos que apoyaban la hipótesis de que la reducción de los niveles de hamartina prolongaría la nefrogénesis.
Interesantemente, TSC1 está mutada en la esclerosis tuberosa, en la cual las personas afectadas a menudo tienen hamartomas renales y quistes junto con anormalidades en otros sistemas de órganos. Sin embargo, no hay pruebas de que las personas con esclerosis tuberosa hayan aumentado el número de nefronas. La respuesta a la pregunta de cómo se deben considerar los hallazgos actuales en el contexto de lo que se conoce clínicamente sobre la esclerosis tuberosa no es del todo clara, pero se podría suponer que la TSC1 mutada sistémicamente en humanos (que afecta a todos los tejidos y no sólo a los riñones) tiene un efecto diferente sobre el fenotipo que la eliminación de un alelo de la TSC1 (específicamente en el riñón) en ratones.
Las implicaciones de estos hallazgos parecen obvias: la hamartina (y sus efectores posteriores) es un blanco candidato para los enfoques experimentales para proteger a los bebés en riesgo y quizás para tratar la enfermedad renal en niños y adultos (en un giro adicional, otros experimentos genéticos de Volovelsky y colegas han demostrado que la mTor puede no ser un efector río abajo de la hamartina en el contexto de la nefrogénesis). Claramente, se necesitará mucho trabajo antes de que las claves para la inducción terapéutica de la nefrogénesis estén al alcance de la mano.
Fuente bibliográfica
Tackling Tsc1 to Promote Nephrogenesis
Julie R. Ingelfinger, M.D.
DOI: 10.1056/NEJMcibr1811985