Terapia génica para corregir la neutropenia
Un estudio preclínico reciente respalda el uso de la edición de genes para eludir los efectos de las mutaciones que causan la condición congénita. Los autores también generaron un modelo de ratón para la enfermedad.
Entre los pacientes con síndromes hereditarios que involucran insuficiencia de la médula ósea, aquellos con neutropenia congénita grave tienen inhibida la maduración de la granulopoyesis, con pocos o ningún neutrófilo maduro en la sangre periférica, y están en riesgo de infecciones bacterianas graves que amenazan la vida poco después del nacimiento. La administración subcutánea de factor estimulante de colonias de granulocitos humanos recombinantes, administrado diariamente de por vida, supera el defecto de diferenciación, aumenta la granulopoyesis y reduce el número y gravedad de las infecciones bacterianas. Sin embargo, esta terapia no es curativa y algunos pacientes no tienen respuesta o esta es muy débil. El trasplante de médula ósea es la única terapia curativa, pero conlleva riesgos de eventos adversos graves, como enfermedad de injerto contra huésped o falla del injerto.
La innovadora implementación de la edición de genes con CRISPR-Cas9 (repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas con una endonucleasa Cas) en el tratamiento de los síndromes hematológicos de anemia de células falciformes y β-talasemia es una esperanza para las personas con neutropenia congénita. La edición del gen CRISPR-Cas9 ex vivo de células madre hematopoyéticas (CMH) seguida de un autotrasplante después de una quimioterapia mieloablativa leve puede curar este trastorno genéticamente heterogéneo, causado por mutaciones en más de 30 genes. Aproximadamente el 50% de los individuos con neutropenia congénita alberga mutaciones de ganancia de función autosómicas dominantes en ELANE, el gen que codifica la elastasa de neutrófilos. Hay más de cien mutaciones conocidas en ELANE que abarcan sus cinco exones. La localización errónea y la acumulación intracelular de elastasa de neutrófilos mutante afecta negativamente a la diferenciación y supervivencia de los progenitores granulocíticos.
La corrección de una sola mutación en ELANE mediante la edición del gen CRISPR-Cas9 de las CMH primarias obtenidas de una granulopoyesis inducida por un paciente y en ratones humanizados, podría beneficiarse con un enfoque "universal" de edición de genes, uno que lidie con la heterogeneidad genética de la enfermedad. La introducción de mutaciones en el segundo exón de ELANE con el uso de CRISPR-Cas9 en células madre hematopoyéticas obtenidas de personas con neutropenia congénita induce la desintegración mediada sin sentido, conduciendo a la eliminación de los ARN mensajeros truncados (ARNm resultantes). De ese modo, se evita la producción y los problemas causados por el ARNm mutante de vida relativamente larga que se traduce en proteínas patógenas. Al hacerlo, se puede restaurar la diferenciación granulocítica in vitro (figura 1).
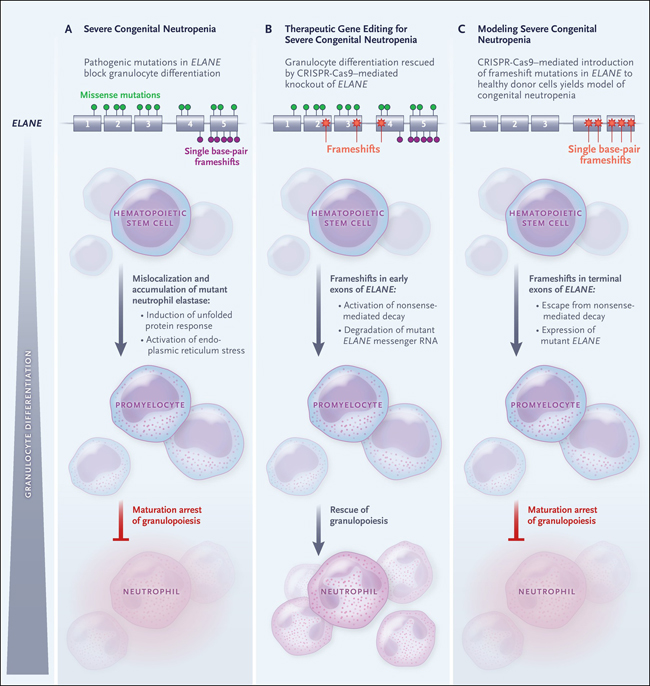
Figura 1: edición de genes en la neutropenia congénita.
Las mutaciones autosómicas dominantes de ganancia de función en ELANE, que codifica la elastasa de neutrófilos, conducen a la localización errónea y la acumulación intracelular de proteínas, creando estrés en el retículo endoplásmico (RE). El estrés del RE, a su vez, afecta la supervivencia y diferenciación de los granulocíticos progenitores (Panel A). La introducción mediada por CRISPR-Cas9 de cambios de marco en los exones tempranos de ELANE (exones 1 a 3 y el comienzo del exón 4) en células madre hematopoyéticas derivadas de pacientes con neutropenia congénita conduce a la descomposición y degradación del ARN mensajero de ELANE y por lo tanto al rescate de la diferenciación granulocítica (Panel B). Por el contrario, la introducción de cambios de marco de un solo par de bases (pb) en los exones terminales de ELANE (los extremos de los exones 4 y 5) con el uso de CRISPR-Cas9 en las células madre hematopoyéticas de personas sanas imita el efecto de las mutaciones patógenas de ELANE, generando un modelo experimental de neutropenia congénita (Panel C).
Un equipo liderado por Shuquan Rao (División de Hematología/Oncología del Hospital de Niños de Boston, Estados Unidos) restauró la granulopoyesis al dirigirse a los exones de ELANE en las CMH de los pacientes y, al injertar estas con genes editados en ratones inmunodeficientes, observándose una granulopoyesis completamente reconstituida (además, en CMH sanas [no mutantes], se pudieron generar cambios de desplazamiento que imitaban mutaciones patogénicas en ELANE, produciendo así ARNm mutantes que eran refractarios a la descomposición. Los investigadores establecieron un modelo animal de neutropenia congénita trasplantando estas HSC en un ratón inmunodeficiente). Por lo tanto, la edición de ELANE mediada por CRISPR-Cas9 es un enfoque eficaz para la edición de genes que puede "corregir" el fenotipo independientemente de la posición y el tipo de mutación de ELANE causal. Esta corrección se puede lograr con alta eficiencia dirigiéndose a las células madre con actividad de repoblación hematopoyética a largo plazo, un requisito esencial para la reconstitución exitosa de la hematopoyesis.
Por tanto, existen datos preclínicos que proporcionan una prueba de concepto para el tratamiento de la neutropenia congénita mediante el autotrasplante de células editadas genéticamente. Sin embargo, como siempre, quedan preguntas sin respuesta: ¿existe un costo biológico al controlar la expresión de ELANE en los neutrófilos? Se justifica una evaluación adicional de los efectos del agotamiento de la expresión de ELANE en los neutrófilos circulantes in vivo. El buen enfoque sería injertar las CMH editadas genéticamente de pacientes con neutropenia congénita en ratones inmunodeficientes. Pero la reconstitución de neutrófilos completamente funcionales en la sangre periférica de ratones injertados es muy ineficaz. Es posible que este obstáculo pueda superarse trasplantando neutrófilos editados genéticamente (derivados, ex vivo, de células madre hematopoyéticas) en embriones de pez cebra. Hay razones para creer que el agotamiento de la elastasa de los neutrófilos no afectará adversamente la función de los neutrófilos. Por ejemplo, la activación de la elastasa de neutrófilos depende de su procesamiento N-terminal por la catepsina C (codificada por CTSC). Los neutrófilos de personas con mutaciones recesivas de pérdida de función en CTSC que causan el síndrome de Papillon-Lefèvre no muestran defectos con respecto a la destrucción de bacterias comunes.
Otra preocupación es que la edición genética de las CMH "no aptas" podría conducir a la adquisición de mutaciones somáticas con potencial leucemogénico. Normalmente, las células madre hematopoyéticas de personas con neutropenia congénita son propensas a la adquisición de ciertas mutaciones asociadas a la leucemia, como en CSF3R y RUNX1. La edición de genes ex vivo de las CMH que albergan tales alteraciones podría provocar la aparición de clones leucémicos agresivos. Esta preocupación se aplica a todos los síndromes preleucémicos que involucran insuficiencia de la médula ósea. La secuenciación profunda del ADN de las células madre hematopoyéticas de los pacientes podría permitir la selección de candidatos con bajo riesgo de transformación. Se debe explorar el potencial de la edición fuera del objetivo mediante la realización de una secuenciación que sea sensible a grandes eliminaciones o traslocaciones. Si bien es atractiva la idea de implementar editores primarios o básicos en la edición de ELANE (enfoque similar al utilizado en la edición con CRISPR-Cas9, pero sin la introducción de rupturas de doble cadena), sería importante realizar ensayos de actividad fuera del objetivo. Además, no está claro qué número de CMH editadas genéticamente es necesario para lograr la reconstitución de la granulopoyesis en humanos.
Dicho todo esto, aunque el uso de este nuevo enfoque para el tratamiento de la neutropenia congénita se limita actualmente a modelos preclínicos, es particularmente prometedor para el manejo de pacientes con la afección. Puede ser especialmente útil en aquellos que no responden al factor estimulante de colonias de granulocitos humanos recombinantes y en quienes ha fracasado el trasplante de médula ósea.
Fuente bibliográfica
Circumventing Mutation to Nix Neutropenia
Julia Skokowa, M.D., Ph.D.
Department of Oncology, Hematology, Clinical Immunology, and Rheumatology, University Hospital Tübingen, Tübingen, Germany.
N Engl J Med 2021; 384: 1956-1958