Cambio molecular en un anticuerpo acelera respuesta inmunitaria contra el cáncer
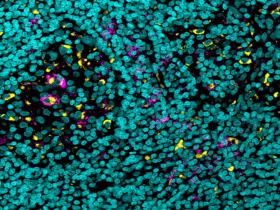
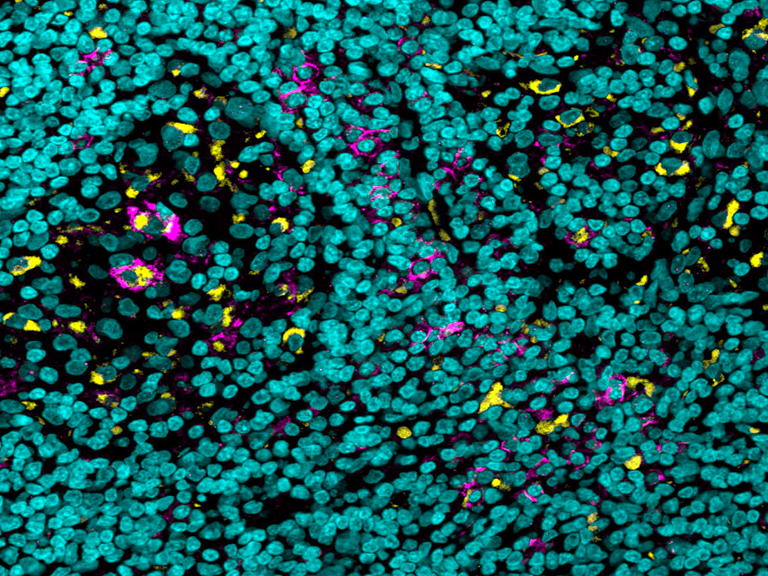
El bloqueo del FcγRIIB inhibidor en combinación con anti-PD-L1 mejoró las respuestas antitumorales. Del mismo modo, la afucosilación de la región Fc de la IgG1 también lo logró y esto se debió a alteraciones en el microambiente tumoral.
En la carretera, pisar el acelerador o el freno controla la velocidad del coche. Esto también ocurre en nuestro cuerpo, al conducir una respuesta inmunitaria. Al igual que los conductores humanos, los anticuerpos tienen un "pie", una especie de extremidad molecular que "pisa" los pedales del acelerador y del freno. Estos pedales son receptores situados en las membranas externas de las células inmunitarias: cuando el pie de un anticuerpo se une a uno de estos pedales, puede acelerar la respuesta inmunitaria o ralentizarla.
Un estudio realizado por un equipo de investigadores dirigido por el Dr. Rony Dahan, del Instituto Weizmann de Ciencias (Israel) revela que un pequeño cambio molecular en un anticuerpo de inmunoterapia común podría permitirle unirse mejor a ciertos receptores acelerando así la respuesta inmunitaria contra el cáncer. También se demuestra que añadir un segundo anticuerpo -que bloquee los inhibidores- puede mejorar la eficacia de los tratamientos.
En 2016, la Administración de Alimentos y Medicamentos de Estados Unidos aprobó un tratamiento de inmunoterapia que utiliza anticuerpos para bloquear una proteína llamada PD-L1. Las células cancerosas pueden aprovecharla para suprimir la respuesta inmunitaria contra ellas "agotando" las células T.
El equipo del Departamento de Inmunología de Sistemas de Weizmann comprobó si los hallazgos son válidos para los fármacos destinados a humanos y para ello, utilizaron los llamados ratones humanizados, en los que se empleó ingeniería genética para sustituir genes receptores de anticuerpos de ratón por otros humanos. Tras inducir tumores, los trataron con dos anticuerpos de uso clínico: uno que no puede unirse a receptores de células inmunitarias (atezolizumab) y otro que sí puede (avelumab).
Los investigadores sabían por estudios anteriores que, mientras que la unión de anticuerpos a la mayoría de los receptores actúa como un acelerador que potencia la respuesta inmunitaria, hay un receptor que actúa como pedal de fren y la unión a este inhibe la respuesta. Un examen más detallado reveló que, en comparación con células similares de otros órganos, había muchos más de estos receptores de pedal de freno en determinadas células inmunitarias del microentorno del tumor. Este fenómeno también se observó en humanos.
En otras palabras, a pesar de que el fármaco reforzaba el sistema inmunitario, el efecto total era algo así como pisar el acelerador y el freno al mismo tiempo. Una vez que los científicos se dieron cuenta de lo que estaba ocurriendo, probaron de nuevo el experimento, esta vez administrando a los ratones un tratamiento combinado de avelumab y un segundo anticuerpo que había demostrado inhibir los receptores inmunosupresores. Con el pie levantado de los frenos del sistema inmunitario, el tratamiento contra el cáncer fue mucho más eficaz.
Pensaron que podrían aumentar aún más la eficacia de los anticuerpos haciendo que pisaran con más fuerza los "pedales del acelerador", es decir, buscaron una forma de hacer que los "pies" de los anticuerpos se unieran más fuertemente a los receptores que refuerzan el sistema inmunitario. Crearon un pequeño cambio en una molécula de azúcar asociada al pie del anticuerpo, un cambio que puede multiplicar por once la afinidad de unión de un anticuerpo. Y efectivamente, tras el tratamiento con los nuevos anticuerpos mejorados, el tamaño de los tumores en los ratones humanizados era menor y el tiempo medio de supervivencia mayor.
Por último, profundizaron en el mecanismo de acción responsable del éxito de su anticuerpo mejorado. Descubrieron que este proporcionaba al tratamiento anticanceroso una doble ventaja: era capaz tanto de aumentar el número de células T que penetraban en el tumor, como de disminuir el número de determinadas células mieloides.
Los hallazgos de esta investigación podrían pasar rápidamente del laboratorio a la clínica, para mejorar los fármacos de los que ya disponen los pacientes de cáncer.