Adipocitos pardos: ni músculo ni grasa
La obesidad está estrechamente asociada con un aumento de diabetes, hipertensión, hiperlipidemia, cáncer y otros trastornos, y ha impulsado un gran interés biomédico sobre las células y los tejidos adiposos. Estos últimos contienen dos tipos distintos de células grasa, las blancas y pardas. Las células grasas blancas se especializan en el almacenamiento de energía a la forma de triglicéridos, mientras que las marrones disipan la energía química en forma de calor. La mayoría de los depósitos grasos pueden caracterizarse como marrones o blancos, pero, en roedores y seres humanos, algunas células pardas también pueden encontrarse dispersas en los depósitos de grasa blanca. Similitudes en la morfología celular, metabolismo lipídico y en los patrones de expresión génica entre los dos tipos celulares han llevado a asumir que existiría un origen común de desarrollo.
Hasta hace muy poco, al tejido adiposo pardo se le atribuía una importancia metabólica sólo en mamíferos más pequeños y lactantes humanos. Recientes investigaciones, sin embargo, sugieren que en los seres humanos adultos tiene varias áreas metabólicamente activas. Las células pardas podrían desempeñar una función mucho más importante en el metabolismo humano. La manipulación de la grasa es un sueño terapéutico evidente, pero la interrupción de la diferenciación o el desarrollo normal del tejido adiposo blanco causa almacenamiento lipídico ectópico y grave patología (lipodistrofia) en personas y animales de experimentación. Pero mejorar las técnicas disponibles ofrecería la posibilidad de aumentar el gasto de energía sin necesidad de causar disfunción en otros tejidos. De hecho, el incremento de tejido pardo en animales se ha asociado con un fenotipo magro y saludable. Por el contrario, su pérdida está vinculada a la obesidad y enfermedad metabólica.
Orígenes del tejido adiposo pardo
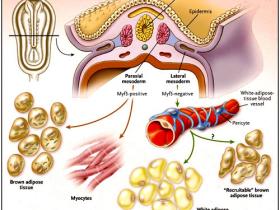
¿Cuál es la fuente de tejido adiposo pardo? Durante la formación de las tres capas germinales, el mesodermo se posiciona entre el exterior (ectodermo) y el revestimiento interior (endodermo). A partir de este "relleno" se desarrollan varios tipos de células especializadas, incluyendo miocitos, adipocitos y condrocitos. Se puede observar una estrecha relación entre estas células cuando el mesodermo se trata con 5-azacitidina, un modificador de nucleótidos, y cuando se sustituyen los residuos de histidina, generando ADN desmetilado o, más bien, el ADN no puede ser metilado. La metilación de citidina se ve comúnmente en las regiones del genoma que son menos activas transcripcionalmente.
Este proceso resulta en la formación de adipocitos y miocitos y, en menor grado, de condrocitos. Sin embargo, hay dos tipos de adipositos: los que constituyen la denominada grasa blanca (almacenan energía en forma de grasa) y los que forman la grasa parda o marrón (queman energía). El tejido adiposo blanco tiene pocas mitocondrias y almacena triglicéridos en gotas de lípidos, mientras que las células del tejido adiposo pardo presentan muchas y pequeñas gotas de lípidos y una gran cantidad de mitocondrias. La grasa parda expresa la proteína 1 desacoplante, llamada así porque separa la síntesis de ATP a partir de la respiración, lo que lleva a la producción de calor.
¿Qué moléculas son cruciales para los linajes celulares de la grasa blanca y marrón? Varias de ellas han sido descritas, y hasta hace poco, se creía la existencia de un origen común. Sin embargo, algunos estudios, incluido el realizado por Patrick Seale y colegas (Nature 2008; 454:961-968), han señalado postulados en contra de un solo origen para los adipocitos. Radhika Atit y colegas habían propuesto un linaje común para el músculo y la grasa marrón sobre la base de que células específicas del dermomiotoma dan lugar a músculos y a células del tejido adiposo marrón, pero no a los adipocitos blancos. En apoyo a lo anterior, están los perfiles de expresión que unen al músculo y a las células grasas marrones (ambos expresan factores miogénicos como el Myf5) y excluyen a los adipocitos blancos.
El grupo de P. Seale utilizó en vivo linajes en la que las células y su progenie que tenían o habían presentado la capacidad de activar el promotor Myf5 e inducir la expresión de un gen marcador. Este marcador sólo estaba en dos tipos celulares, los adipocitos marrones y los miocitos, apuntando claramente a objetivos celulares similares (figura 1). Este resultado fue apoyado por la expresión del factor de transcripción PRDM16 en los cultivos de mioblastos, los que se convierten a adipocitos marrones. A la inversa, es decir, la “desactivación” de PRDM16 en los adipocitos marrones, indujo la miogénesis. Aunque este hallazgo sugiere que puede existir una célula precursora bipotente para el músculo y los adipocitos marrones, no excluye la posibilidad de que estas células se originen de diferentes linajes positivos para Myf5.
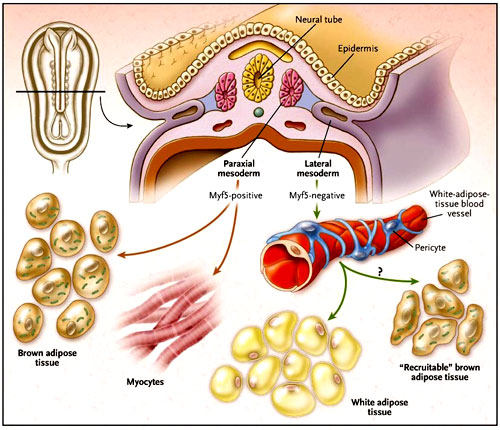
El estudio realizado por P. Seale y colegas demostró que si bien algunas células del tejido graso pardo derivan de precursores que se originan a partir del dermomiotoma que expresa Myf5 (derivado del mesodermo paraxial), otras células marrones tienen un origen diferente. Los adipocitos blancos negativos para Myf5 y que derivan de los pericitos proceden de la placa lateral del mesodermo. Por lo tanto, son evidentes dos vías, una que involucra las células que expresan o han expresado el factor de transcripción Myf5 (que tiene un papel clave en la regulación de la diferenciación muscular) y otra que no implica tales células. Las unidades marrones interscapulares y perinefríticas proceden de vías moleculares positivas para MYF, mientras que los adipocitos marrones que son inducidos a diferenciarse por estimulación adrenérgica se originan de una vía negativa para MYF, como en el caso de los adipocitos blancos.
Sin embargo, también está claro a partir del trabajo de P. Seale que hay dos tipos de células en el tejido graso marrón. Las que son inducidas por estimulación adrenérgica y negativas para el marcador y, por tanto, derivan de un linaje que nunca ha expresado Myf5. Estas unidades se intercalan en el tejido adiposo blanco y, probablemente, proceden de la activación de células precursoras latentes. En contraste, las células marrones originadas de células positivas para Myf5 están localizadas en zonas clásicas del tejido adiposo marrón, por ejemplo, alrededor de los riñones, y entre los omóplatos. Por lo tanto, es posible que el origen de las células marrones sometidas a diferenciación en respuesta a señales ambientales, como la estimulación adrenérgica, difiera de las células positivas para Myf5 derivadas del dermomiotoma. Este hallazgo de dos fuentes de adipocitos marrones se apoya en los estudios que indican que la variabilidad genética afecta la trasformación de adipocitos marrones en grasa blanca, pero no en células marrones interscapulares.
¿Cuál es la relación entre estos diferentes tipos de adipocitos marrones? ¿Cuáles son las diferencias? Una sub-población de pericitos ha sido implicada como fuente de células precursoras de adipocitos blancos. Quizás, células marrones negativas para Myf5 (inducibles por estímulos externos) también deriven de pericitos, y las células musculares y adipocitos pardos positivos para Myf5 se originen de células del dermomiotoma.
Recientes informes sobre el tejido adiposo pardo en adultos sugieren que estas unidades tienen un papel importante en la regulación del gasto energético humano. Cuestiones relativas a la procedencia y regulación del tejido adiposo marrón son pertinentes para las intervenciones farmacológicas destinadas a facilitar el reclutamiento de células marrones en el tratamiento de la obesidad. Es probable que estas terapias puedan inicialmente dirigirse hacia las células progenitoras negativas para Myf5, que son incorporadas por estímulos adrenérgicos.
Fuente bibliográfica
The Origins of Brown Adipose Tissue
Sven Enerbäck, M.D., Ph.D.
Sahlgrenska Academy, Institute of Biomedicine, University of Gothenburg, Gothenburg, Sweden.
N Engl J Med. 2009 May 7;360(19):2021-3