Tuberculosis
Granuloma, ¿amigo o enemigo?
Al inicio de la tuberculosis pulmonar, el Mycobacterium tuberculosis (MTB) inhalado es tomado por células fagocíticas y transportados a través del epitelio alveolar en el pulmón. Allí, los macrófagos infectados integran más macrófagos y otras células inmunitarias para formar estructuras organizadas denominadas granulomas, las cuales representan singularidades patológicas de la tuberculosis.
Se cree que los granulomas benefician al hospedador gracias a la contención y restricción de las micobacterias. Una de las razones de este postulado es que se creía que los granulomas sólo se formaban después de la iniciación de la inmunidad adaptativa, y en modelos animales de la tuberculosis, el crecimiento bacteriano es rápido durante las primeras 2 semanas de la infección alcanzando el máximo con el desarrollo de la inmunidad adaptativa. Por lo tanto, según el modelo clásico, la formación de granulomas requiere de la inmunidad adaptativa, fundamental para limitar la expansión de las bacterias.
Este estudio trata de determinar los mecanismos por los que las micobacterias podrían sacar provecho de este tipo de respuesta y protección, como es la formación de granulomas.
Conocimientos sobre la tuberculosis
Los granulomas son agregados celulares que representan características patológicas de la tuberculosis. Desde hace mucho tiempo se cree que estas lesiones inflamatorias crónicas son necesarias para la contención de la infección. Un reciente estudio realizado por Davis y Ramakrishnan (Cell 2009; 136:37-49), sin embargo, sugiere que los granulomas pueden ayudar a promover la infección, en lugar de contenerla.
La gran mayoría de las personas infectadas con el Mycobacterium tuberculosis son asintomáticas durante toda su vida, al menos el 90% de los adultos infectados no se enferman. ¿Cuál es la base para la resistencia? Las elevadas tasas de tuberculosis clínica entre personas infectadas con el virus de la inmunodeficiencia humana y también entre las que reciben terapia citotóxica representan un punto crítico de la función adaptativa del sistema inmunológico intacto. Sin embargo, el factor celular más importante pueden ser los macrófagos, que tienen dos funciones contradictorias en la tuberculosis. Por una parte, son capaces de eliminar, o al menos controlar el crecimiento de M. tuberculosis. Además, los granulomas están presentes en las personas con inmunidad intacta, pero ausentes o mal formados en individuos con pobre respuesta inmune; esta observación apoya la hipótesis que son esenciales para limitar el crecimiento bacteriano. Por otro lado, los macrófagos proporcionan un nicho de crecimiento para estos organismos intracelulares; desde el principio hasta el final de la infección.
La hipótesis que los granulomas limitan el crecimiento bacteriano se basa principalmente en modelos animales que no permiten la observación del desarrollo infeccioso en el tiempo. Como los granulomas se localizan en los tejidos profundos, la mayoría de los modelos requieren el sacrificio de los animales infectados para permitir el estudio de la interacción entre las bacterias y las estructuras del hospedador. Así pues, se han tenido que sacar conclusiones acerca de un proceso dinámico a partir del análisis de puntos únicos en el tiempo.
Aunque el pez cebra no puede se infectado con el M. tuberculosis, éste es un anfitrión natural del M. marinum. Más importante aún, el embrión de pez cebra (que también es un anfitrión de M. marinum) es transparente, permitiendo la fácil visualización de las bacterias que viven al interior. Davis y Ramakrishnan infectaron al pez cebra con un M. marinum que expresaba proteínas fluorescentes. Las células fagocíticas, el equivalente en el pez de los macrófagos humanos, a continuación, “marcaron” las bacterias, permitiendo a los investigadores a seguir la suerte de los fagocitos infectados y no infectados a lo largo del tiempo por medio de microscopía (figura 1). Las células infectadas reclutaron fagocitos no infectados. Como las células infectadas mueren, al parecer vía apoptosis, son absorbidas por células no infectadas que previamente estaban infectadas. Estas células proporcionan un nuevo nicho de crecimiento para el agente patógeno y permiten el crecimiento bacteriano.
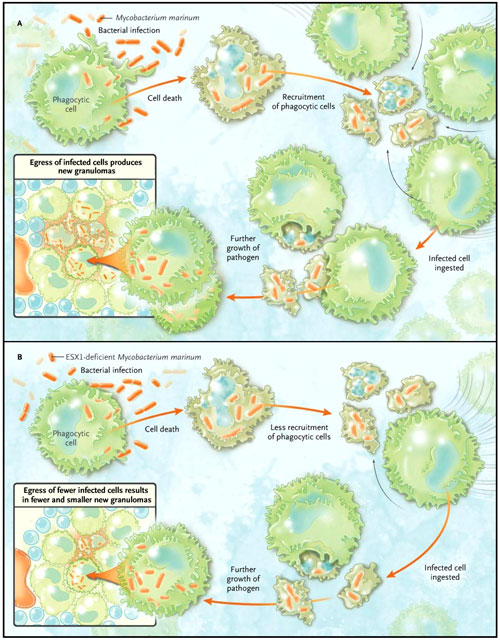
Los investigadores JM Davis y L. Ramakrishnan observaron que el crecimiento de Mycobacterium marinum en la célula fagocítica del pez cebra (equivalente a los macrófagos humanos) eventualmente conduce a la muerte celular (panel A). Las células infectadas reclutan células no infectadas, algunas de las cuales ingieren células infectadas, generando nichos para un mayor crecimiento patógeno y permitiendo la salida de las células infectadas para producir nuevos granulomas. La infección con bacterias que no tienen la región de virulencia crítica ESX1 (panel B) resulta en un menor reemplazo de células no infectadas y, en consecuencia, un menor número de bacterias, menos lesiones y cantidad de nuevos granulomas.
Los autores observaron que M. marinum discapacitantes con una mutación en el locus ESX1, región cromosómica crítica en la virulencia de M. tuberculosis, es capaz de infectar a los fagocitos, pero no de manera eficiente para realizar nuevas rondas de infección. Por lo tanto, el crecimiento de M. marinum mutante se restringió por un inesperado mecanismo de atracción, por factores bacterianos, de células no infectadas con el fin de crear un entorno favorable para el crecimiento de patógenos.
¿Cómo traducir este modelo para la tuberculosis? Existen importantes diferencias en los agentes patógenos y el hospedador. Por ejemplo, mientras que M. tuberculosis reside en gran medida dentro de vacuolas en la célula infectada, M. marinum puede escapar al citoplasma y, probablemente, aprovecharse de los eficientes mecanismos de propagación de célula a célula. Además, el embrión del pez cebra carece de un sistema inmune adaptativo, y la adaptación del sistema inmune humano es crítica para contener la infección por M. tuberculosis en etapas posteriores. La remodelación del granuloma en el ser humano con las aportaciones de las células inmunitarias y la liberación de citoquinas podrían producir un entorno menos hospitalario para los patógenos que para el granuloma de los peces.
Sin embargo, hay que derribar los castillos de arena. Por ejemplo, ahora se duda que un primer encuentro entre el M. tuberculosis pulmonar y los macrófagos conduzca inevitablemente a la cronicidad de la infección. Nuevos análisis, y más específicos, indican que el contacto de los pacientes con la tuberculosis a menudo crea una respuesta inmune que posteriormente sirve, lo que sugiere que los seres humanos tienen mecanismos innatos para la erradicación en la primera de la infección. El estudio de Davis y Ramakrishnan sugiere que interferir en la señalización entre el patógeno y el huésped puede inclinar la balanza a favor de la erradicación de la infección.
Fuente bibliográfica
The Granuloma in Tuberculosis — Friend or Foe?
Eric J. Rubin, M.D., Ph.D.
Harvard School of Public Health, Harvard University, Boston.
N Engl J Med. 2009 Jun 4;360(23):2471-3