SUMO1 para la insuficiencia cardíaca
La sumoilación es un proceso de modificación postraduccional de las proteínas SUMO (siglas en inglés para small ubiquitin-like modifier) que son covalente y reversiblemente conjugadas con sus objetivos (por ejemplo, a un aminoácido lisina de una proteína blanco) a través de reacciones enzimáticas en cascada. Desde el descubrimiento de SUMO-1 en 1996, la vía SUMO ha centrado la atención debido a su papel en una serie de importantes actividades biológicas como la progresión del ciclo celular, modulación epigenética, transducción de señales y la replicación/reparación del ADN, así como su posible implicación en la patogénesis humana, como el desarrollo del cáncer y la metástasis, enfermedades neurodegenerativas y los defectos craneofaciales. El papel de la vía SUMO en la regulación, el desarrollo y/o trastornos cardiogénicos, es un tema realmente emergente.
Mediante experimentos en animales, hoy se sabe que SUMO1, el llamado "acompañante" de la proteína que regula la actividad del transportador de genes clave, se encuentra reducido en los corazones con enfermedad cardíaca. Cuando se ha inyectado SUMO1 en estos corazones a través de terapia génica, la función cardíaca mejora de forma significativa, indicando que SUMO1 puede jugar un papel crítico en la patogénesis de la insuficiencia cardíaca.
Calcio y proteínas SUMO en la insuficiencia cardíaca
Una anomalía clave en la insuficiencia cardíaca es el manejo defectuoso de los iones de calcio en los cardiomiocitos. En el corazón sano, el potencial de acción conduce a un aumento de calcio intracelular (y posterior sístole) a través de dos mecanismos. En primer lugar, el calcio extracelular entra a la célula por los canales de calcio tipo L. El consiguiente aumento de la concentración de calcio intracelular conduce a la apertura del receptor de rianodina tipo 2, y la liberación de calcio desde el retículo sarcoplásmico. En segundo lugar, la inversión de estos cambios se produce durante la relajación cardíaca (diástole), provocando la eliminación de calcio al espacio extracelular. Esta expulsión se produce por medio de la extrusión de calcio a través del intercambiador sodio-calcio y su reabsorción en el retículo sarcoplásmico por el cierre del receptor de rianodina 2 y, lo más importante de todo, a través de la activación de la isoforma 2a de ATPasa de calcio del retículo sarcoplásmico (SERCA2a) (figura 1). Se han descrito fallas en cada mecanismo en la insuficiencia cardíaca, las que conducen a anomalías tanto en la diástole como la sístole, y a una mayor propensión a arritmias ventriculares.
La reducción de la expresión y actividad de SERCA2a ha sido demostrada en modelos animales de insuficiencia cardíaca y en cardiomiocitos aislados de corazones explantados de pacientes sometidos a trasplante. Por el contrario, el aumento de expresión de SERCA2a se asocia con la mejoría del inotropismo y la lusitropia en cardiomiocitos aislados y con una optimización de la función cardíaca en modelos experimentales de insuficiencia cardíaca. Recientemente, en un pequeño ensayo aleatorizado, la transferencia génica de SERCA2a dio lugar a una mejora en la situación clínica global de los pacientes con insuficiencia cardíaca sistólica, destacando aún más la importancia de SERCA2a como diana terapéutica en esta condición.
Es en este contexto, Changwon Kho y colaboradores (Nature 2011; 477:601-605) han sugerido otra forma en la que la actividad de SERCA2a podría ser manipulada. Estos autores encontraron que los niveles y la actividad de SERCA2a en cardiomiocitos se modulan de forma paralela con los niveles de una proteína citoplasmática, el modificador similar a ubiquitina (SUMO1). Los SUMO son una familia de péptidos que altera la función de otras proteínas en las células por una modificación postraduccional descrita como sumoilación, la cual está implicada en la modulación de diversos procesos celulares como el transporte desde el núcleo hasta el citoplasma, la transcripción y la estabilización de proteínas y la degradación a través del proceso reversible de SUMO a la proteína diana. De esta forma, las actividades de muchas proteínas intracelulares importantes son modificadas, incluyendo los receptores de esteroides, proto-oncogenes, los supresores de tumores y los factores de transcripción cardíaco.
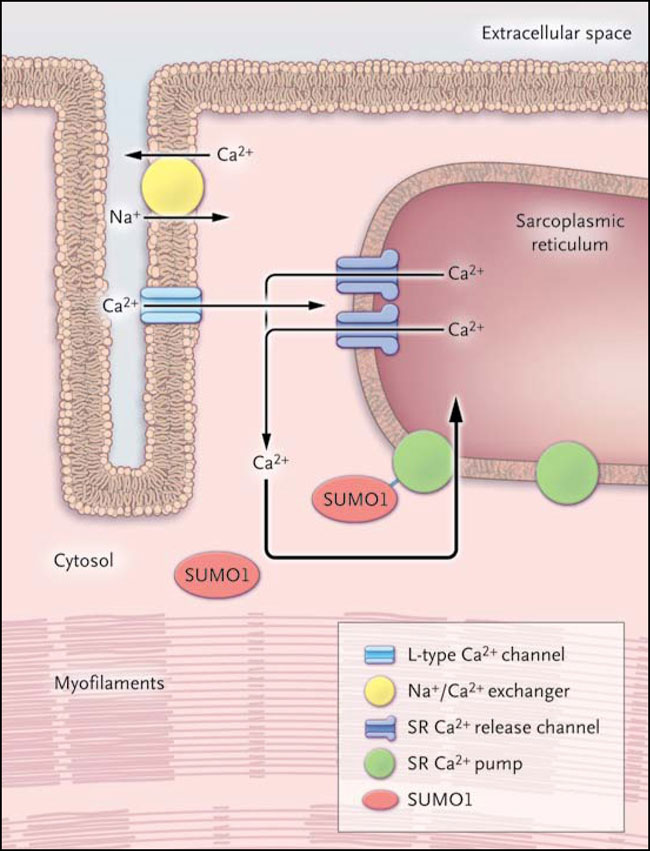
El equipo de Changwon Kho encontró que la sumoilación parece prolongar la vida útil de SERCA2a en la célula, así como aumentar la actividad intrínseca de SERCA2a ATPasa. Los autores también determinaron que los niveles de SERCA2a y SUMO1 se redujeron en los modelos de ratón y de cerdo para la insuficiencia cardíaca y en cardiomiocitos aislados de ventrículos no humanos. Para determinar si la reducción de los niveles de SUMO1 es responsable de la disminución de la proteína SERCA2a y de la función cardíaca, los investigadores utilizaron un método de transfección de virus para sobre-expresar SUMO1 en un modelo de ratón para insuficiencia cardíaca (inducida por la constricción de la aorta torácica). Ellos demostraron que el aumento de los niveles de SUMO1 llevó a una recuperación de los niveles de SERCA2a, mejor rendimiento hemodinámico y reducción de la mortalidad entre los animales con fallo cardíaco. Los autores ampliaron sus resultados mediante la transferencia de cardiomiocitos aislados obtenidos de ratones operados y ratones con constricción de la aorta con SUMO1- o SERCA2a- para la expresión del virus, demostrando que las mejoras inotrópicas y lusitrópicas en las células estaban relacionadas con cambios en el manejo del calcio intracelular. Además, los autores crearon un ratón knock para SUMO1, lo que permitió regular la expresión de SUMO1 hasta después de la insuficiencia cardíaca desarrollada en ratones con constricción aórtica. Este estudio muestra claramente que la sobre-regulación de SUMO1 mejoró la hemodinámica cardíaca.
Al examinarse la expresión de otras proteínas manipuladoras del calcio, curiosamente, los niveles del intercambiador sodio-calcio, universalmente sobre-regulado en la insuficiencia cardíaca, habían disminuido a valores normales, una señal de que la normalización SERCA2a también puede generar, indirectamente, la normalización de las otras proteínas de manejo del calcio. Los autores también redujeron la expresión de SUMO1 mediante la utilización de una horquilla corta de ARN, disminuyendo los niveles de SERCA2a y la función de bombeo del corazón en ratón. Estas experiencias permitieron entender el enlace con el intercambiador sodio-calcio, ya que su niveles fueron mayores después de disminuir la regulación de SUMO1, sugiriendo nuevamente que la expresión de estas dos proteínas claves está relacionada.
Un hallazgo significativo fue que la reducción de la función cardíaca debido a la menor expresión de SERCA2a no se podría mejorar por la sobre-regulación de SUMO1 sin sus efectos estimulantes sobre SERCA2a. Esta es una observación importante, ya que la sumoilación conduce a la modificación de traslación de una serie de proteínas intracelulares que podrían haber cambiado la función cardíaca, independientemente de SERCA2a.
El presente análisis concluye que la existencia de la modificación de una proteína cardíaca inducida por SUMO, demostrando un nuevo mecanismo de modulación de la actividad de SERCA2a y la función cardíaca extracorpórea. El desafío terapéutico será la especificidad de la intervención, dada la naturaleza omnipresente de la vía SUMO1.
Fuente bibliográfica
Calcium Handling in the Failing Heart and SUMO — Weighing the Evidence
John J.V. McMurray, M.D., and Godfrey L. Smith, Ph.D.
Institute of Cardiovascular and Medical Sciences, University of Glasgow, Glasgow, United Kingdom.
N Engl J Med 2011; 365:1738-1739