Asedio genético para vencer el cáncer de mama
Mediante análisis genómicos se han logrado identificar miles de ARN no codificantes largos (ARNncl). Particularmente, Malat1 (transcrito 1 de adenocarcinoma pulmonar asociado a metástasis) es uno de los más abundantes, y su expresión se encuentra alterada en diversos tipos de cáncer. Investigaciones que se han basado en la aplicación de oligonucleótidos antisentido (ASO) en modelos animales para el estudio del cáncer de mama, muestran que la deleción génica de Malat1 resulta en una reducción del crecimiento tumoral, junto con una notoria diferenciación hacia un fenotipo quístico con baja capacidad invasiva hacia otros órganos. Estos hallazgos revelan por primera vez un rol funcional de Malat1 en la regulación de la patogénesis de este tipo de cáncer, lo que constituye una atractiva diana terapéutica para inhibir la progresión cancerígena.
ARN no codificantes y cáncer
El dogma central de la biología molecular postula que los genes se transcriben en ARN mensajeros (ARNm), los que luego se traducen en proteínas, que son las responsables en última instancia de todas las funciones celulares. Sin embargo, investigaciones recientes han puesto de manifiesto que los ARN que no codifican proteínas -conocidos como ARN no codificantes (ARNnc) - juegan un rol importante en los procesos fisiológicos normales, pudiendo además contribuir a enfermedades como el cáncer. De hecho, aproximadamente sólo el 1,5% de las cerca de mil millones de pares de bases del genoma humano da cuenta de secuencias codificante para proteínas, mientras que la gran mayoría del ADN es transcrito a ARN (sin la posterior síntesis proteica) bajo determinadas condiciones. Estos hallazgos han planteado la posibilidad de que los ARN no codificantes representen un depósito no explotado de potenciales dianas terapéuticas para diversas enfermedades.
Sin embargo, existen pocos estudios en animales para el análisis de enfermedades humanas que hayan demostrado beneficios terapéuticos al inhibir un ARNnc con el uso de fármacos. Pese a ello, los resultados descritos recientemente por Gayatri Arun y colegas (Genes Dev. 2016 Jan 1;30(1):34-51), proporcionan un emocionante ejemplo de las posibilidades que tienen los ARNnc para convertirse en dianas terapéuticas para el tratamiento de cáncer de mama. Por otra parte, la estrategia experimental que usaron, podría ser ampliamente aplicada para combatir muchas enfermedades humanas.
Una clase heterogénea de ARNnc, conocidos como ARN no codificantes largos (ARNncl) - definidos simplemente por tener una longitud superior a 200 nucleótidos - ha sido objeto de recientes e intensos estudios. Uno de los primeros ARNncl humano en ser descubierto, fue identificado debido a su alta expresión en células cancerígenas metastásicas de pulmón, en comparación con sus contrapartes no metastásicas. La elevada expresión del transcrito de adenocarcinoma pulmonar asociado a metástasis (MALAT1) se ha vinculado subsecuentemente con la propagación de células cancerosas a otros tejidos y con una reducida supervivencia en pacientes con múltiples tipos de tumores.
En células cancerosas humanas cultivadas en laboratorio, la inhibición de MALAT1 resulta en la disminución de la proliferación celular, supervivencia, migración y capacidad invasiva, así como en una reducción de metástasis, cuando las células son implantadas en ratones inmunodeprimidos. Sorprendentemente, los ratones que poseen una deleción completa de Malat1 se desarrollan sin dificultades y tienen un período de vida normal, lo que indica que este ARNlnc es prescindible fuera del contexto del cáncer. Estos resultados plantean la posibilidad de que la inhibición de MALAT1 podría debilitar el crecimiento tumoral, la metástasis, o ambos, con mínimos efectos secundarios.
A través de la inhibición genética y farmacológica de Malat1 en un modelo de ratón bien caracterizado para el estudio del cáncer de mama tipo luminal B, Arun y sus colegas han proporcionado pruebas irrefutables de que el enfoque en este ARNncl podría representar un tratamiento seguro y eficaz para este tipo de cáncer. Los investigadores documentaron que el cáncer de mama en los seres humanos a menudo tiene niveles elevados de MALAT1 en lesiones metastásicas. Para probar si Malat1 promueve la metástasis, generaron ratones knockout para este gen y se criaron junto a ratones que expresan un fuerte oncogen de tejido mamario (ratones MMTV-PyMT). En ratones deficientes de Malat1 producto del cruce de ambos animales, se evidenciaron tumores quísticos con bajo potencial metastásico. Contrariamente, en ratones con niveles de expresión normales de Malat1, se observó el desarrollo de carcinomas mamarios agresivos y poco diferenciados, propensos a la metástasis pulmonar.
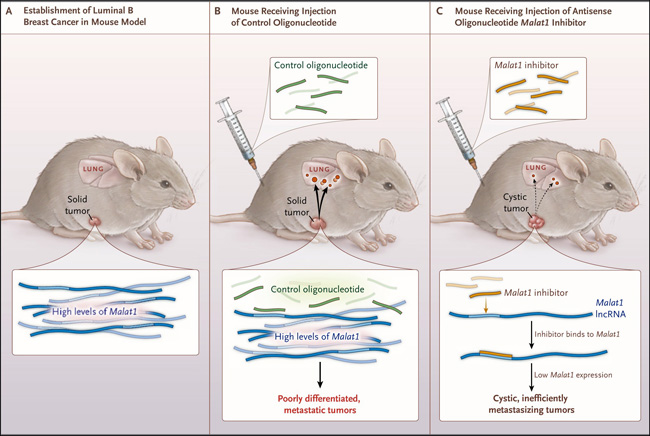
Figura 1. Un mazo molecular para silenciar MALAT1.
El ARN no codificante largo (ARNncl) MALAT1 se expresa abundantemente en tumores presentes en modelos de ratón para el cáncer de mama metastásico luminal B (panel A). La inyección subcutánea de oligonucleótidos de control en estos animales, después de la formación tumoral, no tiene ningún efecto sobre la expresión de Malat1, resultando en un cáncer pobremente diferenciado con alta capacidad invasia hacia el pulmón (panel B). Por otro lado, la inyección subcutánea de inhibidores antisentido que reducen los niveles de MALAT1 en células cancerígenas, resulta en la formación de quistes, escasamente metastásicos (panel C). Dado que la expresión de MALAT1 también es elevada en metástasis de cáncer de mama humano, estos hallazgos apoyan la investigación clínica de terapias anti-MALAT1 para estas patologías.
Posteriormente, para modelar más cercanamente un escenario clínico, los autores utilizaron oligonucleótidos antisentido (ASO) para inhibir la expresión de Malat1 en ratones con tumores mamarios establecidos (figura 1). La inyección subcutánea de ASO anti-Malat1 reduce fuertemente la expresión de este ARNncl. Sorprendentemente, los tumores en animales tratados con ASO, exhibieron un fenotipo quístico, con esacasa metástasis, similar a los animales con deleción génica de Malat1 (ratones knockout). Estos resultados proporcionan un fuerte apoyo para una ulterior investigación clínica de inhibidores de MALAT1 para el tratamiento de cáncer de mama y posiblemente otros tipos de tumores.
A pesar de los notables efectos de la deleción de Malat1 en el modelo de ratón MMTV-PYMT, el mecanismo a través del que este ARNncl influye en el comportamiento cancerígeno permanece sin ser comprendido en su totalidad. Aunque MALAT1 fue uno de los primeros ARNncl en ser descubierto, su función aún es poco conocida. Su secuencia nucleotídica se ha conservado a través de la evolución, lo que sugiere fuertemente que posee una función celular importante. Además, se asocia con miles de genes codificantes para proteínas, influyendo ampliamente sobre la abundancia de ARNm y niveles de splicing. Sin embargo, sigue siendo incierto cómo estos efectos generales sobre la expresión génica pueden influir el comportamiento de células cancerígenas sin tener un impacto identificable en células normales. Por ende, futuras investigaciones acerca de la función molecular de MALAT1 serán un componente crítico de los esfuerzos para llevar las terapias anti-MALAT1 a la práctica clínica.
Es tentador especular que el ARNncl MALAT1 representa la punta del iceberg como candidato a una diana terapéutica. El genoma humano codifica miles de ARNncl cuyas funciones aún no se han caracterizado en los procesos fisiológicos normales y en los patológicos. De esta forma, su inhibición (en caso de que sea posible dirigirla a tejidos blanco relevantes) pueden ser beneficiosa para los pacientes. Por otra parte, la estrategia que involucra a los ASO utilizados por Arun y sus colegas para inhibir MALAT1, podría potencialmente, adoptarse para ser oriantada a cualquier secuencia de ARN no codificante. Por lo tanto, la mayor exploración de las funciones moleculares, fisiológicas y fisiopatológicas de estas moléculas no traducidas en proteínas tiene el potencial de ampliar el arsenal clínico para el tratamiento de muchas enfermedades.
Fuente bibliográfica
Targeting a Long Noncoding RNA in Breast Cancer
Joshua T. Mendell, M.D., Ph.D.
Howard Hughes Medical Institute and the Department of Molecular Biology, University of Texas Southwestern Medical School, Dallas.
N Engl J Med. 2016;374(23)2287-2289
Temas Relacionados