Ausencia proteica propulsora del adenocarcinoma
El desarrollo del cáncer invariablemente involucra proteínas celulares que tienen efectos no deseados o que se vuelven inactivas. La terapéutica dirigida a proteínas que son más activas de lo normal es conceptualmente sencilla: es necesario encontrar un fármaco que, como una llave lanzada a una máquina, detenga la actividad maliciosa. Por el contrario, remediar la pérdida de un tipo de proteína supresora de tumores, que normalmente se opone al crecimiento del cáncer, presenta un dilema. ¿Cómo puede una proteína ser atacada por los medicamentos si ya no está presente? Una forma de sortear este problema y encontrar nuevas dianas de medicamentos es identificar otros efectos, como los cambios moleculares que se producen cuando un supresor tumoral se pierde o no funciona.
Proteína del retinoblastoma
En un reciente estudio Walter y colaboradores (DOI: 10.1038/s41586-019-1172-9) reportan el análisis del papel de la proteína supresora de tumores del retinoblastoma (pRb), utilizando un sistema experimental que les permitió diseñar la pérdida y reactivación de esta proteína en cáncer de pulmón en ratones. Desde el descubrimiento de la actividad supresora de tumores de la pRb a partir de estudios en niños con un tipo de cáncer ocular y la posterior identificación de la pérdida o inactivación de la pRb como característica de muchos tumores humanos, esta proteína ha servido de modelo para el estudio de supresores tumorales en cáncer. La proteína del Rb puede actuar como un freno clave en la progresión del ciclo celular, y promueve la diferenciación en tipos celulares específicos, lo que retarda el desarrollo del cáncer. Muchos cánceres bloquean la función de la pRb al aumentar la actividad de las enzimas quinasas dependientes de ciclina (Cdk), que inactivan a pRb a través de la fosforilación (figura 1a). Los tratamientos contra el cáncer que incluyen inhibidores de Cdk4 y Cdk6 para evitar que desactiven a la pRb han mostrado cierto éxito. Sin embargo, como era de esperar, estos inhibidores no son eficaces si no se expresa pRb en los tumores.
Walter y sus colegas estudiaron los efectos de la pérdida de pRb en un modelo de ratón de una forma común de cáncer pulmonar: el adenocarcinoma de pulmón. Los autores utilizaron animales genéticamente modificados para controlar la producción de pRb en las células de cáncer de pulmón. Esto mostró que la ausencia de pRb (estado llamado knockout de pRb) promueve el desarrollo del cáncer al causar un aumento tanto en el crecimiento del tumor como en su propagación a sitios secundarios (metástasis). Los resultados proporcionan algunas de las pruebas in vivo más sólidas hasta ahora para apoyar un papel de la pérdida de pRb en la conducción no sólo de la iniciación del cáncer, sino también de su progresión.
Los autores observaron que los cambios moleculares que conducen a la progresión y metástasis en este modelo de cáncer de pulmón son sorprendentemente diferentes, dependiendo de si pRb está presente o ausente. Si faltaba pRb, en comparación con la situación en la que estaba presente pero inactivada por Cdk, las células cancerosas tenían una mayor propensión a cambiar su identidad celular a un estado menos diferenciado que permitía que la enfermedad progresara más rápidamente. Este estado fue acompañado por la expresión de proteínas promotoras de metástasis como HMGA2. Tal desdiferenciación celular en ausencia de pRb también se ha observado en el cáncer de próstata. Aunque se desconoce el mecanismo preciso que controla la plasticidad celular en este escenario, podría implicar la activación de factores involucrados en la reprogramación celular, como el factor de transcripción SOX2, que normalmente es inhibida por pRb.
Basándose en estudios previos que investigaron la pérdida de pRb en modelos de cáncer de ratón, Walter y sus colegas estudiaron el efecto de restablecer la expresión de la pRb en ratones con cáncer de pulmón meses después de que su gen codificante hubiera sido eliminado por ingeniería genética. Encontraron que la reexpresión de pRb promovía la rediferenciación de las células cancerosas, haciendo que los tumores fueran menos malignos. Esta observación es importante, porque sugiere que las estrategias para reactivar la pRb o para manipular proteínas que actúan río abajo de ella podrían ser terapéuticamente beneficiosas para tratar cánceres que han perdido la expresión de pRb.
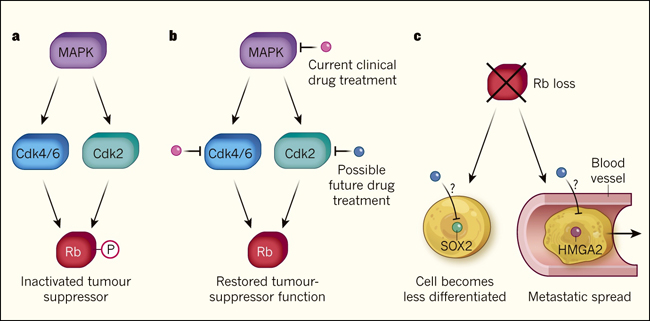
Figura 1. La proteína del retinoblastoma en las células cancerosas.
a, Rb es un tipo de proteína conocida como supresor tumoral, que puede ayudar a bloquear el desarrollo del cáncer. Una característica común del cáncer de pulmón es la inactivación de Rb por la adición de grupos de fosfato (P) a la proteína. Esto ocurre frecuentemente a través de una vía que requiere varias enzimas: MAPK; Cdk4 y Cdk6; o Cdk2. b, Los medicamentos que bloquean la acción de MAPK o Cdk4 y Cdk6 están en uso en la clínica o en desarrollo para el tratamiento del cáncer de pulmón. Walter y colaboradores (DOI: 10.1038/s41586-019-1172-9) estudiaron un modelo de ratón de cáncer pulmonar, y reportaron que Cdk2 tiene un papel importante en la inactivación de Rb. Por lo tanto, el desarrollo de medicamentos que se dirigen a esta proteína podría ser prometedor en el tratamiento del cáncer de pulmón. c, La expresión de Rb a menudo se pierde en las células cancerosas de pulmón (amarillas). Los autores estudiaron el efecto de la pérdida de Rb en estos modelos de cáncer. La ausencia de Rb resultó en la pérdida de la diferenciación celular y un aumento en la propagación de células cancerosas a otras partes del cuerpo vía metástasis. Las proteínas implicadas en tales cambios, como SOX2 y HMGA2, podrían ofrecer objetivos para el desarrollo de nuevos medicamentos.
Otra observación clave realizada por los investigadores es que los tumores que carecen de pRb no aumentan una vía de señalización que contenga la quinasa MAPK, que a menudo se activa en el adenocarcinoma de pulmón. Esto no había sido reportado anteriormente y es inesperado, dado que la regulación excesiva de la vía es un sello distintivo de este tipo de cáncer.
El éxito clínico de los inhibidores de Cdk4 y Cdk6 indica que la manipulación de la actividad de pRb puede detener la progresión del cáncer. Sin embargo, el desarrollo de resistencia a tales terapias está motivando la búsqueda de otros fármacos que puedan imitar la reactivación de la función de pRb, y de nuevos objetivos para combatir las células cancerosas que han perdido la expresión. El éxito de Walter y sus colegas en la identificación de los efectos moleculares y celulares de la pérdida de pRb, como la desdiferenciación celular y la ausencia de un aumento de la señalización MAPK, ayudará en estos esfuerzos.
La señalización MAPK puede inactivar a pRb a través de varios mecanismos. Los resultados de los autores indican que la inhibición de pRb es el resultado de una mayor señalización de MAPK que inactiva una proteína inhibidora de Cdk llamada p27, activando así a Cdk2, que a su vez puede fosforilar y por lo tanto inactivar a pRb. Las observaciones de los autores con respecto a la interacción entre MAPK y Cdk2, implican a esta última enzima como un blanco potencial para medicamentos en cánceres de pulmón que retienen pRb pero son resistentes a los inhibidores de Cdk4 y Cdk6. En este contexto, la inhibición combinada de MAPK y Cdk2, o de Cdk4, Cdk6 y Cdk2, podría detener potentemente el crecimiento de los tumores pulmonares al asegurar que pRb permanezca en su estado activo y no se asocie con altos niveles de fosforilación (figura 1b).
Sin embargo, es necesario seguir trabajando para identificar nuevas dianas potenciales de medicamentos. También se deben hacer esfuerzos para determinar la sensibilidad del cáncer en cada persona, a los inhibidores de Cdk4 y Cdk6 o Cdk2, incluyendo la evaluación del perfil genético del individuo y el monitoreo de las alteraciones o cambios epigenéticos, modificaciones al ADN o a las proteínas de unión al ADN que pueden afectar la expresión génica. Además, sería útil identificar proteínas o vías que inhiban la desdiferenciación celular que ocurre después de la pérdida de pRb (figura 1c).
Por último, será esencial comprender hasta qué punto los principios del desarrollo y progresión del cáncer de pulmón son aplicables a otros tipos de cáncer. El sistema experimental utilizado por Walter y colaboradores podría ayudar a afrontar este reto, ya que sus resultados podrían dilucidar el efecto de la pérdida de proteínas supresoras de tumores en diversos contextos. Los estudios de la proteína del Rb han proporcionado durante mucho tiempo un modelo útil para investigar los mecanismos fundamentales de la supresión tumoral. Ahora también podrían ofrecer una manera de avanzar en la detección de nuevas estrategias contra el cáncer.
Fuente bibliográfica
Manipulating the tumour-suppressor protein Rb in lung cancer reveals possible drug targets
Seth M. Rubin & Julien Sage
Departments of Pediatrics and of Genetics, Stanford University, Stanford, California 94305, USA.
DOI: 10.1038/d41586-019-01319-y