Beta bloqueadores y citoquinesis cardioprotectora
Actualmente, un millón de individuos con enfermedades cardíacas congénitas viven solamente en los Estados Unidos. Estos pacientes tienen un riesgo de por vida de desarrollar insuficiencia cardíaca. Mediante el análisis del tejido cardíaco de un bebé con tetralogía de Fallot con estenosis pulmonar se demostró que la insuficiencia de la citoquinesis de los cardiomiocitos está aumentada en esta forma común de patología cardiovascular congénita. Utilizando el perfil transcripcional de una sola célula se descubrió que el mecanismo subyacente del fallo de la citoquinesis es la represión del gen ECT2, río abajo respecto a receptores β-adrenérgicos. La desactivación de los genes β-AR y la administración de β-bloqueadores como propanolol aumentó la división de cardiomiocitos en ratones neonatos, lo que incrementó el número de cardiomiocitos y además beneficia a adultos tras un infarto de miocardio. El propranolol permitió la división de cardiomiocitos afectados con la tetralogía de Fallot bajo condiciones in vitro, por lo que se sugiere que los β-bloqueadores podrían ser evaluados para aumentar la división de cardiomiocitos en pacientes con estas condiciones cardiovasculares.
Nucleación y tetralogía de Fallot
Las opciones de tratamiento de las enfermedades cardíacas congénitas están limitadas por la relativa incapacidad de las células musculares cardíacas maduras (cardiomiocitos) para generar nuevos cardiomiocitos mediante su proliferación después del nacimiento. El conocimiento actual sobre la forma en que los cardiomiocitos humanos proliferan durante el crecimiento del corazón es incompleto, debido al limitado acceso al tejido cardíaco de lactantes y niños. Además, los estudios en animales, incluidos ratones y cerdos, están limitados por el hecho de que los seres humanos difieren de otros animales en el momento de la parada del ciclo celular durante el desarrollo y en el número de núcleos por cardiomiocito individual.
Por lo tanto, estas limitaciones hacen que un estudio de la división celular en una enfermedad cardíaca congénita, del que informaron recientemente Liu y colaboradores (DOI: 10.1126/scitranslmed.aaw6419) sea notable por sus conclusiones. Anteriormente se había establecido -mediante el uso de muestras humanas y estimaciones de las tasas de renovación basadas en la exposición incidental a la radiación- que los cardiomiocitos humanos tienen bajas tasas de proliferación durante la infancia (aproximadamente 1% da lugar a dos células de progenie cada año) y suelen tener un solo núcleo, aunque aproximadamente 20% de los cardiomiocitos de un recién nacido tienen dos núcleos (binucleados). La binucleación y multinucleación de los cardiomiocitos se debe a que no logran completar la citoquinesis (figura 1), última etapa de la división celular, durante la cual el citoplasma de una célula en división se separa en alineación con los núcleos recién formados, al mismo tiempo que se forma un surco de separación en la membrana plasmática, que luego se contrae y sella cada célula hija.
La tetralogía de Fallot con estenosis pulmonar es una grave malformación cardíaca congénita que requiere múltiples cirugías en los primeros años de vida. La afección implica cuatro defectos cardíacos (defecto septal ventricular, estenosis de la válvula pulmonar, una aorta mal posicionada e hipertrofia del ventrículo derecho) y está asociada con la señalización adrenérgica activada en los cardiomiocitos y un aumento de la incidencia de enfermedades cardiovasculares en los adultos. Liu y sus colegas obtuvieron muestras de biopsia del miocardio de 12 lactantes y niños afectados que se sometieron a una reparación quirúrgica cardíaca y compararon sus cardiomiocitos con los de adultos jóvenes sanos. Los cardiomiocitos de los lactantes y niños con tetralogía de Fallot y estenosis pulmonar tenían niveles mucho más altos de binucleación y multinucleación (40 a 60%) que los de los adultos jóvenes sanos (aproximadamente 20%). Además, en un solo lactante que tenía tetralogía de Fallot con estenosis pulmonar y que recibió el trazador isotópico no radiactivo 15N al mes de edad, una muestra de biopsia obtenida a los 7 meses mostró evidencia de división nuclear sin citoquinesis, lo que indica que la insuficiencia de citoquinesis es una característica de la cardiopatía congénita en este caso.
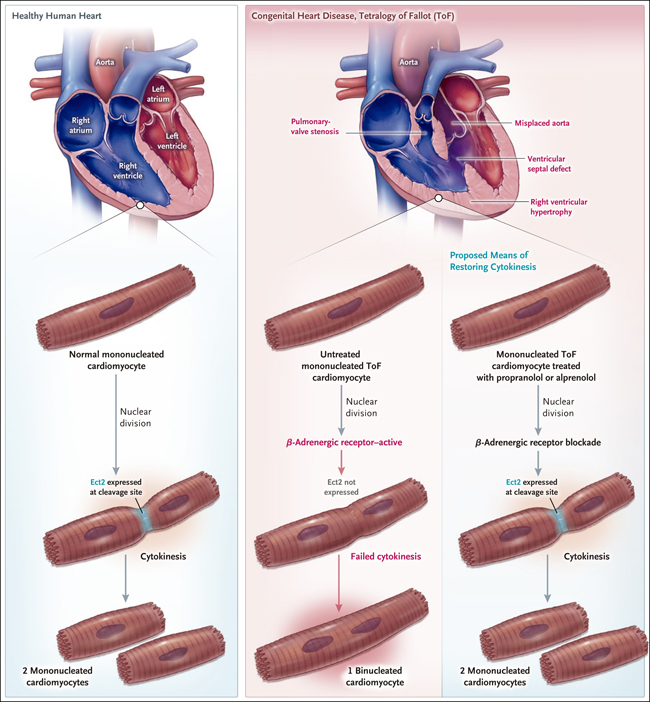
Figura 1. El cardiomiocito y la citoquinesis.
Los resultados de los estudios realizados por Liu y colaboradores mostraron que el fallo de los cardiomiocitos para completar la última etapa de la citoquinesis es una característica de la tetralogía de Fallot y que este fallo está vinculado a la señalización adrenérgica. Múltiples rondas de fallo de citoquinesis conducen a la creación de cardiomiocitos multinucleados que se ven en la tetralogía de Fallot. Los estudios de cardiomiocitos murinos y humanos implican a la proteína Ect2 (epithelial cell transforming 2) en la división celular de los cardiomiocitos y apoyan el uso de beta bloqueadores como posible estrategia terapéutica para promover la citoquinesis de cardiomiocitos en el contexto de la tetralogía de Fallot en bebés humanos.
Las diferencias en la nucleación de cardiomiocitos pueden depender de la causa genética de la tetralogía de Fallot o del tipo de defecto cardíaco congénito, y la medida en que este mecanismo puede generalizarse no puede evaluarse sobre la base de los 12 pacientes examinados por los investigadores. Sin embargo, es evidente que la norma actual de reparación quirúrgica de las malformaciones estructurales congénitas presentes en pacientes con tetralogía de Fallot no corregirá las anomalías cardiomiocíticas individuales, un hallazgo que puede afectar a los resultados cardíacos en adultos.
Liu y sus colaboradores también realizaron estudios en corazones de roedores para identificar los mecanismos de la insuficiencia de la citoquinesis en cardiomiocitos. Los vídeos de la división de cardiomiocitos neonatales de ratas mostraron que la binucleación resulta de la falla de la división de las células para completar la citoquinesis. Los experimentos realizados con ratones transgénicos mostraron que la proteína Ect2 -que regula la señalización intracelular que efectúa cambios en las proteínas estructurales importantes en la motilidad y adhesión citoplasmática- está presente en el surco de clivaje durante la citoquinesis y que está disminuida en cardiomiocitos binucleados. Además, es crítica para la citoquinesis de los cardiomiocitos. Los autores observaron también que la expresión de Ect2 en cardiomiocitos de lactantes con tetralogía de Fallot y estenosis pulmonar era baja en comparación con la expresión en cardiomiocitos control. Sin embargo, no describieron datos normativos sobre la expresión de Ect2, la citoquinesis o la proliferación de cardiomiocitos en lactantes humanos sanos, debido a la escasez de tejido (se da prioridad al trasplante cuando se dispone de un corazón infantil sano). Por consiguiente, es difícil saber cómo interpretar estos resultados en el contexto de un corazón normal.
Mediante experimentos en los que utilizaron ratones genéticamente modificados y cardiomiocitos cultivados de seres humanos con tetralogía de Fallot, los investigadores demostraron también que inhibir la señalización de los receptores beta adrenérgicos (con los beta bloqueadores propranolol y alprenolol) puede utilizarse para aumentar los niveles de Ect2 y promover la citoquinesis de los cardiomiocitos y así aumentar su número tras el nacimiento. Debido a que los cardiomiocitos murinos son normalmente binucleados, no está claro cómo se pueden traducir estos resultados para su aplicación en humanos. Sin embargo, los beta bloqueadores se utilizan ampliamente en cardiología pediátrica para el tratamiento de la miocardiopatía hipertrófica y la insuficiencia cardíaca. Sobre la base de los resultados, los beta bloqueadores podrían investigarse como tratamiento para los lactantes y niños con tetralogía de Fallot y estenosis pulmonar.
Fuente bibliográfica
Cytokinesis, Beta-Blockers, and Congenital Heart Disease
Katherine E. Yutzey, Ph.D.
Division of Molecular Cardiovascular Biology, Cincinnati Children’s Medical Center, Cincinnati.
NEJMcibr1913824