Biosíntesis de LPS revela ruta hacia nuevos antibióticos
La inhibición de la retroalimentación se produce cuando el producto de una vía metabólica disminuye su propia producción al desencadenar una disminución de la actividad de una enzima clave de una vía. En el caso de algunas bacterias, esa inhibición controla la producción de moléculas de lipopolisacáridos (LPS), que forman parte integral de la membrana externa. Desde hace tiempo se sospecha que la señal de retroalimentación responsable de la regulación de la biosíntesis del LPS es el propio LPS o uno de sus precursores. Sin embargo, en una reciente publicación, Thomas Clairfeuille y colaboradores se suman a una oleada de trabajos que muestran que la proteína de membrana PbgA es el -largamente buscado- transductor de señales del LPS en la bacteria Escherichia coli. El estudio amplía nuestra comprensión sobre cómo PbgA, una de las pocas proteínas esenciales de E. coli sin una función bien caracterizada, transduce la señal del LPS y proporciona información para el desarrollo de antibióticos.
PbgA y equilibrio lipídico
E. coli tiene dos membranas distintas: la membrana interna, que es una bicapa de fosfolípidos; y la membrana externa asimétrica, en la que el LPS recubre la superficie externa, y una única capa de fosfolípidos forma la superficie interna. El LPS proporciona una barrera a los antibióticos y detergentes que se encuentran en el intestino de mamíferos hospederos. La proporción entre fosfolípidos y LPS es crucial para la función de la membrana - demasiado LPS es tóxico para la membrana interna y muy poco compromete la membrana externa.
El ensamblaje del LPS comienza en la superficie interna de la membrana interna de E. coli. La velocidad de ensamblaje está controlada por la enzima LpxC. Antes de que se complete la generación de LPS, el lípido se voltea a la superficie externa de la membrana interna para su posterior modificación. El LPS completado es entonces transportado a la superficie externa de la membrana exterior por medio de un puente de proteínas que conecta las membranas.
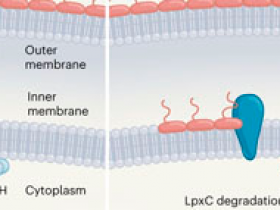
Investigaciones sobre cómo se regula esta vía, han producido un modelo en el que PbgA en la membrana interna modula la actividad de la enzima LpxC interactuando con LapB, una proteína que guía a la enzima FtsH a degradar la LpxC1. Así que cuando los niveles de LPS son bajos, PbgA inhibe la interacción entre LapB y FtsH en la membrana interna, estabilizando a LpxC y promoviendo la biosíntesis de LPS (figura 1a). Cuando el número de moléculas de LPS supera un umbral en la membrana externa, su transporte a través del puente cesa. El LPS se acumula en la superficie externa de la membrana interior, lo que puede causar la formación de estructuras de membrana irregulares potencialmente letales. Al detectar el LPS acumulado, PbgA puede relajar su inhibición de LapB-FtsH. La LpxC puede degradarse, disminuyendo así la biosíntesis del LPS y restableciendo el equilibrio fosfolípido-LPS (figura 1b). El trabajo de Clairfeuille y sus colegas apunta ahora al mismo mecanismo de detección de LPS, añadiendo peso a este modelo emergente (DOI: 10.1038/s41586-020-2597-x).
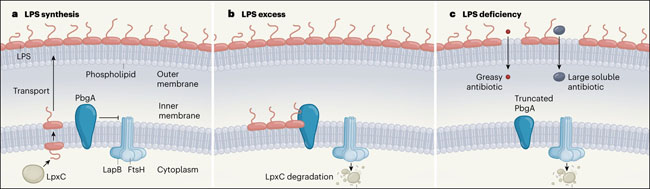
Figura 1 | La inhibición de la retroalimentación regula la biosíntesis de los lipopolisacáridos.
La bacteria Escherichia coli tiene una membrana interna compuesta por dos capas de fosfolípidos y una membrana externa, que tiene una capa de fosfolípidos y una capa de moléculas de lipopolisacáridos (LPS). a, La enzima LpxC controla la biosíntesis de LPS a partir de los precursores en el citoplasma celular. Después de ser volteada a la superficie externa de la membrana interna, el LPS maduro es transportado a la membrana externa. La enzima FtsH, guiada por interacciones con la proteína LapB, degrada a LpxC - pero Clairfeuille y colaboradores muestran que la proteína PbgA inhibe la actividad de la LapB-FtsH, y por lo tanto promueve la biosíntesis del LPS. b, Cuando el exceso de LPS se acumula en la superficie externa de la membrana interna, se une a PbgA. La proteína relaja su control sobre LapB-FtsH, permitiendo la degradación de LpxC para restaurar los niveles normales de LPS. c, Una mutación de truncamiento de PbgA lleva a un agotamiento crónico del LPS, presumiblemente porque la proteína mutante solo inhibe débilmente la LapB-FtsH. Los fosfolípidos llenan los huecos dejados por el LPS en la membrana exterior, permitiendo que los antibióticos y detergentes penetren en las bicapas de fosfolípidos locales, y que los grandes compuestos solubles se filtren a través de los defectos de los límites transitorios donde las fases LPS y fosfolipídica se encuentran.
Los autores corroboraron el hallazgo de que las cepas de E. coli portadoras de formas truncadas de PbgA (que carecen de dominios extracelulares y de enlace que normalmente se conectan a su dominio transmembrana esencial) siguen siendo viables, pero tienen una deficiencia crónica de LPS (figura 1c). En estos mutantes, los fosfolípidos migran a la superficie externa de la membrana exterior para crear membranas mixtas que contienen parches de bicapa de fosfolípidos dispersos entre las zonas de la membrana de fosfolípidos-LPS. Los parches bicapa de fosfolípidos permiten el ingreso de antibióticos y detergentes, y los defectos transitorios en los límites entre las dos fases lipídicas diferentes permiten la fuga de grandes moléculas solubles.
Trabajos previos han demostrado que un grupo funcional graso llamado palmitato, se incorpora al LPS cuando los fosfolípidos están presentes en la superficie externa. Clairfeuille y colegas demostraron la presencia de palmitato en el LPS de la membrana externa de un mutante de PbgA. También se ha informado de esa incorporación de palmitato en bacterias portadoras de mutaciones en componentes de los sistemas de transporte que desplazan al LPS hacia la membrana externa y a los fosfolípidos lejos de ella. ¿Qué nos sugieren estas observaciones sobre la función de PbgA? Podrían encajar con la propuesta de que PbgA es una proteína de transporte para la cardiolipina fosfolipídica. Sin embargo, el bloqueo directo de la biosíntesis del LPS también puede conducir al agotamiento del LPS, y a la incorporación del palmitato en la membrana externa. Como tal, la aparente influencia del PbgA en el transporte de cardiolipina parece ser una consecuencia secundaria de su papel en la regulación de la biosíntesis del LPS. En apoyo de esta idea, Clairfeuille y colegas confirmaron el hallazgo de que PbgA era necesario para que la membrana externa conservara su integridad, mientras que la eliminación de la cardiolipina no tenía ningún efecto.
El avance clave de Clairfeuille y sus colegas fue analizar la estructura de PbgA a una resolución de 1,9 ångströms, utilizando una técnica llamada cristalografía de rayos X. Descubrieron que pertenece a una familia de enzimas que también incluye a EptA, una proteína que añade una modificación molecular derivada de los fosfolípidos al dominio del lípido A del LPS. El lípido A está compuesto por dos azúcares fosforilados. Al modificar estos grupos fosfatos, EptA proporciona a las células resistencia a los antibióticos que se unen al lípido A, como polimixinas.
Los autores mostraron que la superficie externa de PbgA estaba estrechamente ligada a una molécula de LPS. Luego reevaluaron una estructura de menor resolución de PbgA y, en base a la distancia entre sus grupos fosfato, verificaron que estaba ligada al dominio lipídico A del LPS. Aunque un fosfolípido ocupa parcialmente un sitio cerca del LPS unido, PbgA ha perdido las cadenas laterales de aminoácidos utilizadas por EptA para catalizar la modificación del LPS. Queda por determinar si PbgA conserva o no la actividad enzimática.
La imagen de PbgA que emerge de la estructura de los investigadores es de una proteína que ha sido adaptada como un receptor para detectar LPS en la superficie externa de la membrana interna. La estructura apoya el modelo de que un circuito regulador de PbgA-LapB-FtsH-LpxC actúa como un mecanismo de control, modulando la biosíntesis del LPS para satisfacer las demandas físicas de las dobles membranas interconectadas de la célula. De hecho, los investigadores también confirman el hallazgo de que se produce una interacción física directa entre PbgA y LapB en las membranas. Pero la forma en que la unión LPS-PbgA relaja la inhibición que ejerce la PbgA en la interacción LapB-FtsH sigue siendo desconocida.
La estructura de Clairfeuille y sus colaboradores revela que PbgA se une a la fracción lipídica A, por medio de un dominio de enlace, utilizando una secuencia de aminoácidos que no ha sido reportada en ninguna otra proteína de enlace LPS. Las mutaciones en este motivo de unión al LPS comprometieron la función de PbgA. En un conjunto final de experimentos, los autores demostraron que un péptido sintético basado en esta secuencia podía unirse al LPS e inhibir el crecimiento bacteriano. A través de un diseño racional, mejoraron el espectro y la potencia antibiótica del péptido.
Las polimixinas se unen al lípido A interactuando con sus dos azúcares fosforilados, pero PbgA se une a uno solo. El antibiótico colistina se utiliza como último recurso para el tratamiento de infecciones en la clínica, pero también puede aumentar la permeabilidad de la membrana externa, sensibilizando así a las bacterias a antibióticos eficaces. Clairfeuille y sus colaboradores demuestran que el péptido derivado del PbgA también sensibiliza a las bacterias a otros antibióticos, actúa en sinergia con la colistina y no se ve obstaculizado por las modificaciones del LPS catalizadas por la EptA.
PbgA era una de las pocas proteínas esenciales de la E. coli sin una función bien caracterizada. El descubrimiento de que PbgA es el transductor de señal del LPS proporciona información para el desarrollo de antibióticos, además de iluminar un notable acto de equilibrio lipídico en la membrana bacteriana.
Fuente bibliográfica
How lipopolysaccharide strikes a balance
Russell E. Bishop
Department of Biochemistry and Biomedical Sciences, and at the Michael G. DeGroote Institute for Infectious Disease Research, McMaster University, Hamilton, Ontario L8S 4K1, Canada.
doi.org/10.1038/d41586-020-02256-x