Burlar las defensas para reparar el corazón
Los ensayos clínicos que utilizan células madre para regenerar el tejido cardíaco dañado continúan hasta el día de hoy, pese a los continuos cuestionamientos sobre su eficacia y a la falta de comprensión acerca del mecanismo del efecto biológico subyacente. La razón de estos ensayos de terapia celular se deriva de estudios en animales que muestran una mejora modesta, pero reproducible en la función cardíaca en modelos de lesión isquémica cardíaca. Un nuevo estudio preclínico analizó la base mecanicista para la terapia celular en ratones después de la lesión por isquemia-reperfusión, y evidenció que, aunque la función cardíaca se mejora, este beneficio no está asociado con la producción de nuevos cardiomiocitos. La terapia celular mejoró la función cardíaca a través de una respuesta inmune estéril aguda caracterizada por la inducción temporal y regional de macrófagos CCR2 + y CX3CR1 +. Para profundizar más en ese hallazgo, investigadores administraron dos tipos distintos de células madre adultas o un inductor químico de la respuesta inmune innata en el corazón de los animales. Esta intervención indujo una acumulación regional similar de macrófagos CCR2 + y CX3CR1 +, evento que se acompañó de un rejuvenecimiento funcional del corazón después de una lesión por isquemia-reperfusión. Esta respuesta selectiva de macrófagos alteró la actividad de los fibroblastos cardíacos, redujo el contenido de la matriz extracelular en la zona del borde de la lesión y mejoró las propiedades mecánicas del área afectada. Por lo tanto, el beneficio funcional de la terapia celular se debe a una respuesta inflamatoria aguda curativa que rejuvenece el área infartada del corazón, más que en el restablecimiento de los cardiomiocitos.
Engañando a los macrófagos
La insuficiencia cardíaca (IC) es una enfermedad pandémica que afecta a casi 6 millones de personas en los Estados Unidos y a 26 millones de personas en todo el mundo. A pesar del desarrollo de nuevos medicamentos y dispositivos para su tratamiento, las perspectivas de los pacientes con la enfermedad siguen siendo sombrías. Hace dos decenios hubo un gran entusiasmo cuando los científicos pretendieron demostrar por primera vez que la inyección de células de médula ósea autólogas en la región periinfarto del corazón de un ratón después de un infarto de miocardio daba lugar a la generación de nuevas células miocárdicas. Sin embargo, el comportamiento terapéutico atribuido a las células derivadas de la médula ósea o del corazón en los primeros estudios ha resultado ser ilusorio. Los ensayos posteriores no mostraron mejora ni siquiera modestos tiempos de supervivencia de las células trasplantadas, hallazgos que sugerían que no actuaban como células madre, y numerosos estudios fundacionales se retractaron. En respuesta a los continuos escándalos y controversias, se ha cuestionado enérgicamente el mecanismo subyacente por el cual la inyección de "células madre" en el corazón dañado puede afectar a los resultados (JAMA Cardiol 2019;4:95-96)
Un estudio reciente de Vagnozzi y colaboradores ofrece una nueva explicación mecanicista sobre cómo la entrega de diversas poblaciones de células al corazón puede mejorar la función del músculo cardíaco lesionado por la isquemia y la subsiguiente reperfusión (Nature 2020;577:405-409.). Estos investigadores examinaron dos poblaciones de células primarias que anteriormente se habían postulado como células madre: las células mononucleares fraccionadas de la médula ósea y las células mesenquimales cardíacas que expresan el receptor tirosina quinasa c-Kit (también conocido como células progenitoras cardíacas), que se administraron como células vivas o como células muertas mediante un ciclo de congelación-descongelación. También probaron el zimosán, un complejo de proteína-carbohidrato derivado de la levadura que se utiliza para inducir la inflamación estéril, utilizando solución salina como control (figura 1).
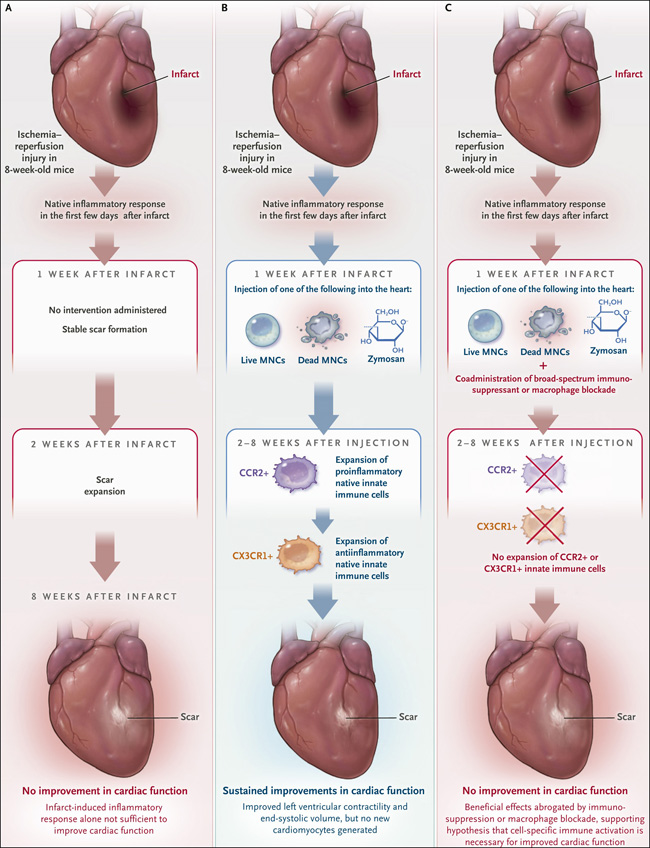
Figura 1. Una respuesta inmunitaria aguda terapéutica en lugar de "terapia celular".
Vagnozzi y sus colegas probaron el mecanismo por el cual la inyección de células madre supuestamente mejora los efectos de la lesión por isquemia-reperfusión (modelación del infarto de miocardio) en ratones. En ausencia de cualquier intervención, la lesión por isquemia-reperfusión en el ratón dio lugar al desarrollo de una cicatriz evidente dentro de la distribución de la arteria coronaria afectada (panel A). Por el contrario, la inyección de células mononucleares (CMN) vivas o muertas, células progenitoras cardíacas vivas o muertas (no mostrado), o zimosán en la región periinfarto, una semana después de la lesión por isquemia-reperfusión condujo rápidamente a la aparición de macrófagos CCR2+ en el lugar de la inyección, seguida de expansión de macrófagos CX3CR1+. Estas respuestas se asociaron con un beneficio funcional que persistió por lo menos durante 8 semanas después de la inyección (panel B). La inmunosupresión o el bloqueo de macrófagos anuló los efectos beneficiosos (panel C).
Cuando los ratones sanos recibieron una inyección de células mononucleares, células progenitoras cardíacas vivas o muertas, o zimosán en el corazón, el número de macrófagos activados aumentó en el área de la inyección y luego disminuyó gradualmente de manera concomitante con la eliminación de las células o el zimosán del corazón. La intervención también causó un cambio en el subtipo de macrófago: los macrófagos CX3CR1+, que abundan en todo el corazón en reposo, mostraron un leve aumento en el número en la periferia del lugar de la inyección, mientras que los CCR2+, que están en gran parte ausentes en el estado naive e implicados en respuestas inflamatorias adversas, mostraron un robusto aumento en su número. Vagnozzi y sus colegas no detectaron ni la génesis de nuevos cardiomiocitos ni la transdiferenciación de células mononucleares inyectadas o células progenitoras cardíacas en cardiomiocitos o células endoteliales. Sin embargo, observaron que la inyección de zimosán daba lugar a un aumento del número de células endoteliales en el lugar de la inyección, pero solo después de que las células mononucleares y las células progenitoras cardíacas se hubieran eliminado.
Una semana después de que los ratones fueran sometidos a una lesión por isquemia-reperfusión, la inyección de células mononucleares, células progenitoras cardíacas o zimosán en la zona del borde del infarto mejoró la contractilidad del ventrículo izquierdo y disminuyó el volumen final sistólico. Para demostrar que la activación inmunológica era necesaria para las mejoras observadas en la función cardíaca, Vagnozzi y sus colegas abrogaron los efectos de la inyección de células o de zimosán mediante la coadministración de un inmunodepresor de amplio espectro o mediante el agotamiento de los macrófagos. De esta forma, los efectos beneficiosos observados se produjeron aparentemente por la activación selectiva de respuestas inmunitarias innatas de una manera que la lesión isquémica no logra por sí sola. Los efectos saludables no dependían de la participación de las células inyectadas; de hecho, el zimosán era el que tenía el efecto más duradero. Cuando los investigadores probaron los efectos mecánicos ex vivo mediante un ensayo de alargamiento forzado en tiras de tejido infartado, descubrieron que el tejido de los ratones que habían recibido una inyección de zimosán en el corazón era el más resistente a la fuerza mecánica, hallazgo que pone de relieve la importancia de la inmunorreactividad sobre cualquier papel activo de los materiales inyectados.
El corazón humano contiene diversas poblaciones de macrófagos, y la insuficiencia cardíaca está influida por un repertorio alterado de células mieloides. Para determinar las funciones respectivas de los macrófagos CCR2+ y CX3CR1+ inducidos en desenlaces cardíacos, los investigadores utilizaron ratones knockout para demostrar que la función cardíaca inmediatamente después de la lesión por isquemia-reperfusión mejoraba en presencia de los macrófagos CCR2+ y que la presencia de los macrófagos CX3CR1+ es importante para las etapas posteriores de la maduración del infarto.
De esta forma, Vagnozzi y otros han explicado los beneficios observados de la terapia de células madre en el tratamiento de las lesiones cardíacas. Su evaluación pone en tela de juicio la continua búsqueda de enfoques terapéuticos basados en células, que son costosos, difíciles de escalar y potencialmente peligrosos. Más bien, subraya el papel fundamental que desempeña el sistema inmunológico en la regulación de la homeostasis cardíaca y la reparación después de una lesión isquémica, lo que sugiere que es necesario un cambio hacia enfoques terapéuticos dirigidos por el sistema inmunitario para facilitar la reparación o regeneración cardíaca, o ambas cosas. Su explicación no excluye la participación de otras vías, como las que regulan la apoptosis y la autofagia, que también influyen en la respuesta del corazón a las lesiones. Dados los rápidos avances que se están produciendo en nuestra comprensión de los subtipos de células inmunitarias y sus funciones en muchas enfermedades humanas, junto con el desarrollo de pequeñas moléculas y productos biológicos para manipular la respuesta inmunitaria, la comunidad de investigación cardiovascular tiene ante sí una enorme oportunidad. Sobre la base de estudios realizados en anfibios, peces y mamíferos, ahora está claro que la especificidad de las células inmunitarias que responden en el contexto de una lesión determina tanto el alcance como la calidad de la reparación.
Fuente bibliográfica
Teasing the Immune System to Repair the Heart
Jonathan A. Epstein, M.D., Nadia Rosenthal, Ph.D., and Arthur M. Feldman, M.D., Ph.D.
Perelman School of Medicine at the University of Pennsylvania
DOI: 10.1056/NEJMcibr2002014