Diferenciación celular para combatir la diabetes
Los islotes de Langerhans en el páncreas contienen células secretoras de insulina (células β) y de glucagón (células α). Ambas hormonas cooperan para regular los niveles de glucosa en la sangre. Actualmente, se sabe que la destrucción o disfunción de las células β conduce a la diabetes y ningún tratamiento puede detener la progresión de la enfermedad ni sus devastadoras complicaciones vasculares. El trasplante de islotes a menudo puede normalizar los niveles de glucosa en sangre durante varios años y prevenir las complicaciones secundarias de la diabetes. Sin embargo, los donantes de órganos son escasos y se necesitan urgentemente fuentes alternativas de este tipo celular. Las células derivadas de células madre son prometedoras a este respecto. Recientemente, Veres y colaboradores (DOI: 10.1038/s41586-019-1168-5) mapearon los pasos moleculares en la diferenciación de las células madre en células de los islotes. Este estudio servirá de base para los futuros esfuerzos por producir células de islotes para trasplantes.
Identidad celular
Las células madre pluripotentes humanas pueden autorrenovarse indefinidamente y generar todo tipo de células en el cuerpo. Por lo tanto, se están realizando inmensos esfuerzos para desarrollar protocolos in vitro para producir células de islotes diferenciadas a partir de las células troncales. Un protocolo ideal promovería la diferenciación de las células madre en células completamente maduras (células α y β), que luego serían aisladas, purificadas y reensambladas en estructuras tipo islote para trasplantarlas a los pacientes. Para lograr un objetivo tan ambicioso, los programas de diferenciación de todas las células de los islotes, y la forma en que se construyen los islotes, deben ser plenamente comprendidos.
Veres y colaboradores analizaron más de 100.000 células en diferentes momentos durante la diferenciación de las células madre en células progenitoras pancreáticas y luego en células productoras de hormonas (endocrinas). La secuenciación del ARN unicelular (scRNA-seq) de las células muestreadas en cada paso del proceso de diferenciación, seguido de análisis computacionales, hizo posible identificar los tipos de células y rastrear sus linajes a través del tiempo. Por lo tanto, los autores produjeron un cuadro detallado de cómo las células progenitoras pancreáticas se desarrollan en diferentes linajes de células diferenciadas (figura 1). Los enfoques actuales para producir células diferenciadas específicas a partir de células madre tienen una eficiencia variable, principalmente debido a la heterogeneidad celular y a la falta de conocimiento sobre los factores de señalización molecular necesarios para el proceso de diferenciación. Por lo tanto, la hoja de ruta de los autores de la diferenciación in vitro entre islotes y células servirá de base para el desarrollo de futuros protocolos de diferenciación.
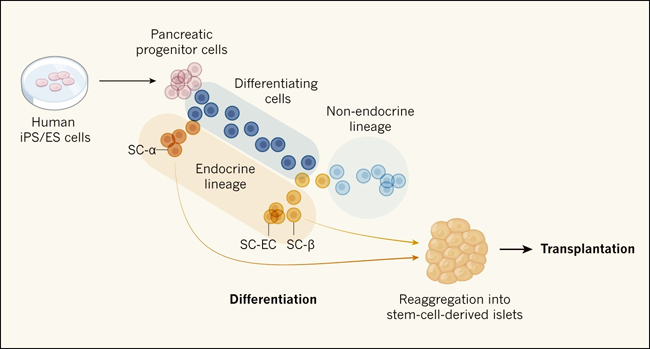
Figura 1. Diferenciación de las células de los islotes pancreáticos humanos in vitro.
Veres y colaboradores (DOI: 10.1038/s41586-019-1168-5) estudiaron la diferenciación de células madre pluripotentes inducidas (iPS) o células madre embrionarias (ES) en: células progenitoras pancreáticas; células madre productoras de hormonas, células α y β derivadas de células madre (SC-α y SC-β) y células que se asemejan a células enterocromafínicas (SC-EC); y células que no producen hormonas (células no endocrinas). Los autores realizaron una secuenciación detallada de ARN unicelular y un análisis computacional para identificar los tipos de células que surgieron con el tiempo, para describir sus relaciones de linaje y para caracterizar sus estados de maduración. Los autores utilizaron un concepto llamado pseudotiempo para definir cómo los perfiles de expresión génica de los diversos tipos celulares cambiaron con el tiempo. También desarrollaron un protocolo de purificación para aumentar el número de células progenitoras endocrinas y células β, lo que supone un paso adelante con respecto a los protocolos utilizados previamente. Este estudio sugiere que las SC-α y SC-β pueden ser purificadas y reagregadas para generar islotes derivados de células madre para la terapia de reemplazo celular.
Veres y sus colegas encontraron que las células progenitoras pancreáticas se pueden diferenciar eficientemente. Sin embargo, las progenitoras tratadas con combinaciones ligeramente diferentes de factores de señalización generaron distintas proporciones de tipos celulares productoras de hormonas y no endocrinas. Esto sugiere que la especificación de progenitores es clave para producir los tipos de células diferenciadas terminalmente deseados. En el estudio, los tres tipos más abundantes de células productoras de hormonas fueron las células madre α (SC-α), las β (SC-β) y las células que se asemejan a las células enterocromafinas (SC-EC). Las células enterocromafinas están normalmente presentes en el intestino y producen serotonina, que contribuye a la regulación de los movimientos intestinales y la digestión.
Curiosamente, las SC-β que se diferenciaron y crecieron durante cinco semanas en ausencia de factores de señalización externos mantuvieron sus propiedades moleculares y funcionales definitorias. En particular, estas células mostraron una secreción estable de insulina estimulada por la glucosa durante ese período. Esta observación indica que la respuesta de la glucosa es un rasgo estable de las SC-β que no requiere factores exógenos, lo que es relevante si las SC-β se van a utilizar en el futuro para el cribado de fármacos antidiabéticos.
Los autores también observaron que las células que expresan las dos hormonas de los islotes -insulina y glucagón- son probablemente SC-α inmaduras, dado que su perfil global de expresión génica coincide con el de células α de islotes en humanos. Estas células polihormonales se convirtieron en células monohormonales que expresan glucagón después de cinco semanas de cultivo, de acuerdo con las observaciones anteriores.
La identificación de SC-EC fue sorprendente, ya que las células enterocromafinas normalmente no están presentes en el páncreas. En particular, permanecieron estables hasta ocho semanas después del trasplante en ratones. La proporción de SC-EC con respecto a las endocrinas pancreáticas (SC-α y SC-β) varió sustancialmente cuando los autores cambiaron el cóctel de factores de señalización administrados en la etapa de diferenciación que coincide con la inducción y el patrón del intestino y el páncreas in vivo. Esta observación sugiere que la especificación de las progenitoras pancreáticas y del intestino es esencial para la generación de células endocrinas específicas del órgano. Diferentes combinaciones de factores de señalización también produjeron diferentes proporciones de tipos de células endocrinas no proliferativas y tipos no endocrinas proliferativas (células pancreáticas acinares y ductales).
Para diseñar equivalentes de islotes derivados de células madre seguros y funcionalmente maduros, los subtipos de células endocrinas deseados deben aislarse y purificarse, y luego volver a agregarse en pseudoislantes. Los autores encontraron que un simple procedimiento de disociación y reagrupación puede eliminar la mayoría de las células proliferativas no endocrinas del cultivo. Además, identificaron la integrina α1 como una molécula de superficie expresada por SC-β. La clasificación de las células magnéticas mediante un anticuerpo anti integrina α1 permitió a los autores obtener cultivos que contenían el 80% de SC-β.
La inducción endocrina -la formación de tipos celulares productores de hormonas en el páncreas- es un paso clave en la diferenciación de las células de los islotes a partir de sus progenitoras. El análisis de la expresión génica de aproximadamente 50.000 células individuales les permitió reconstruir las relaciones de linaje entre las células progenitoras pancreáticas humanas y los tipos diferenciados de células endocrinas utilizando un enfoque computacional previamente desarrollado llamado orden pseudotemporal (figura 1). También reveló el orden en que estos tipos de células emergen, y los cambios moleculares dinámicos que ocurren a lo largo de cada trayectoria de diferenciación. Otros estudios han utilizado el análisis de secuencias de ARNsc y el análisis computacional para producir series de tiempo (en lugar de instantáneas temporales individuales) y para modelar la dinámica poblacional de las células involucradas en los procesos de desarrollo embrionario. Este enfoque combinado podría utilizarse para optimizar el momento de las distintas etapas de los protocolos de diferenciación.
¿Qué tan cerca estamos de un producto terapéutico para el reemplazo las células β? Ya se está llevando a cabo un ensayo clínico para probar la seguridad y eficacia del trasplante de células madre derivadas de progenitores pancreáticos en personas con diabetes tipo 1, con el fin de restablecer el control de la glucemia (go.nature.com/2feyyud). Sin embargo, las células progenitoras pancreáticas trasplantadas aún necesitan diferenciarse y madurar en células β para lograr una secreción efectiva de insulina estimulada por la glucosa. Dado que no se pueden controlar los factores de señalización a los que están expuestas las células in vivo, es deseable desarrollar un producto que secrete insulina en respuesta a la glucosa cuando las células están todavía en cultivo, y que sea efectivo tan pronto como sean trasplantadas. Además, trasplantar sólo SC-β podría no ser suficiente para tratar la diabetes tipo 1, ya que las células α también son esenciales para el control estricto de la secreción hormonal de los islotes humanos y para la regulación general de los niveles de glucosa.
Fuente bibliográfica
A map of β-cell differentiation pathways supports cell therapies for diabetes
Fabian J. Theis & Heiko Lickert
Institute of Diabetes and Regeneration Research, German Research Center for Environmental Health, 85764 Neuherberg, Germany.
DOI: 10.1038/d41586-019-01211-9