El lado amable de los linfocitos T citotóxicos
Actualmente, existe un amplio conocimiento acerca de cómo el sistema inmunológico responde a diversos patógenos invasores. Sin embargo, se desconoce en parte como se previenen las agresiones a bacterias beneficiosas del cuerpo. Recientemente, se ha identificado una vía que permitiría a las células inmunitarias detectar y responder a esta clase de bacterias, que forman conforman la microbiota. Particularmente, se evidenció que bacterias comensales de la piel pueden inducir respuestas en células T que son desacopladas de la inflamación y distintas de las inducidas por patógenos. Tales eventos no solo promueven la protección de microorganismos comensales, sino que también aceleran el proceso de reparación tisular. Esto refleja que la microbiota puede inducir una forma pleiotrópica de inmunidad adaptativa gracias a la omisión de la actividad citotóxica mediada por células T.
Respuesta inmune “no convencional”
El sistema inmunológico realiza un difícil acto de equilibrio. Debe responder rápidamente a los microorganismos peligrosos que amenazan al huésped, pero también coexistir pacíficamente con la gran variedad de microorganismos que colonizan las superficies de barrera como las de la piel y el intestino. En un reciente estudio Linehan y sus colegas examinan las interacciones entre las células inmunitarias y una bacteria que normalmente reside en la piel, e identifican una vía de señalización que gobierna la respuesta inmunitaria frente a dichos microbios (DOI: 10.1016/j.cell.2017.12.033).
La mayor parte de la investigación inmunológica se ha centrado en cómo las células inmunitarias reconocen y eliminan los patógenos virales y bacterianos, y los conocimientos obtenidos han llevado al desarrollo de muchas terapias. Sin embargo, también se ha prestado atención a las comunidades microbianas en las superficies de las barreras y a la influencia a largo plazo que ejercen sobre las respuestas inmunitarias del huésped. Por consiguiente, Linehan y sus colegas estudiaron la bacteria que habita en la piel Staphylococcus epidermidis en ratones y monos rhesus, y analizaron muestras clínicas de tejido humano.
El Staphylococcus epidermidis pertenece a un grupo de microorganismos llamados comensales, y generalmente coloniza la piel humana sin causar enfermedad. Sin embargo, en recién nacidos prematuros y personas que se encuentran en estado de inmunodepresión o que han recibido articulaciones artificiales, S. epidermis puede causar enfermedad grave o infección crónica. Además, aunque la bacteria es normalmente inofensiva, no es ignorada por el sistema inmunológico. En la piel de ratones, la respuesta a un encuentro inicial con ciertas cepas de S. epidermidis está dominada por la célula T CD8+ citotóxica. Los investigadores plantearon dos interrogantes clave sobre esta respuesta, y las explicaciones que se obtuvieron son esclarecedoras.
La primera pregunta fue, ¿cómo reconocen las células T a S. epidermidis? Se cree que se produce una respuesta a las bacterias cuando una célula T reconoce un fragmento de péptido bacteriano unido al componente proteico 'clásico' del complejo mayor de histocompatibilidad (MHC, por sus siglas en inglés), que presenta tales fragmentos a las células inmunitarias. Sin embargo, utilizando un sistema de modelo de ratón, Linehan y sus colegas encontraron que una proteína "no clásica", H2-M3, que pertenece a la familia de los MHC de clase Ib, estaba involucrada en la presentación antigénica de S. epidermidis. H2-M3 puede presentar 4 péptidos bacterianos en los que el residuo de aminoácido metionina ha sido modificado mediante la adición de un grupo N-formilo.
La otra pregunta a la que trataron de responder fue si esta vía no clásica de reconocimiento inmunológico también podría estar relacionada con el comportamiento "no convencional" de las células T. El equipo investigó esto comparando los patrones de expresión génica de las células T CD8+ que responden a S. epidermidis con los de otros tipos de población de células T en la piel del ratón que no responden a la bacteria. Los autores encontraron que las células T CD8+ receptivas expresaban genes asociados con la cicatrización de heridas y la reparación de tejidos (figura 1). Esto fue sorprendente porque se esperaba que las células T CD8+ que respondían, expresaran genes asociados con la activación de vías citotóxicas o con la liberación de moléculas proinflamatorias.
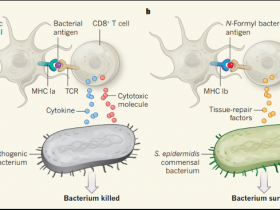
Figura 1. Respuesta de las células T asesinas a la infección bacteriana.
a, Una célula inmune llamada célula T CD8+ (célula T citotóxica) puede contribuir al control de la infección por una bacteria patógena. El receptor de células T (TCR) reconoce la infección cuando un péptido bacteriano (antígeno) es presentado por células dendríticas mediante una proteína MHC clase Ia. Se desencadena entonces una respuesta convencional de células T y la liberación de citoquinas y moléculas citotóxicas que provocan inflamación y destrucción bacteriana. b, Linehan y sus colegas reportan un análisis de la respuesta de las células T asesinas frente a Staphylococcus epidermidis usando modelos de ratón y células humanas. Este tipo de bacteria comensal, puede convertirse en un residente no patógeno a largo plazo en el cuerpo. Las células T reconocen a S.epidermidis cuando una molécula de MHC de clase Ib presenta un antígeno que contiene una modificación N-formil de un residuo de aminoácido. La célula T expresa genes asociados con la reparación del tejido, y la bacteria sobrevive a esta respuesta "no convencional".
Utilizando un modelo de ratón in vivo de curación de heridas cutáneas en asociación con la colonización de S. epidermidis, los autores demostraron que la firma de la expresión génica de reparación tisular en las células T responsivas estaba relacionada con la promoción de una respuesta de curación. Por lo tanto, el reconocimiento inmunológico de residentes bacterianos de la piel puede inducir una forma de inmunidad que no toma represalias directas contra la bacteria, sino que ayuda a la reparación de los tejidos.
El hallazgo de los autores se suma a un creciente reconocimiento de las diversas funciones de otras células T no convencionales que se encuentran en sitios de barrera y que pueden reconocer moléculas microbianas conservadas evolutivamente. Estas células incluyen, por ejemplo, las células T invariantes asociadas a la mucosa, que son abundantes en humanos e inducidas por comensales, y que comparten varias características de la población de células T estudiada por los autores, como la producción de la molécula de señalización interleucina-17A (IL-17A).
Estas y otras poblaciones de células en humanos y ratones, como las células asesinas naturales (NK) invariantes, también actúan en respuesta al reconocimiento de péptidos bacterianos mediados por MHC de clase Ib. En humanos, todavía no se ha identificado un equivalente a H2-M3 de ratón. Es posible que, de encontrarse tal equivalente, una población de células T humanas podría desempeñar un papel similar al de las células T CD8+ observadas por Linehan y sus colegas.
Como señalan los autores, muchas de las interacciones diarias entre las células del sistema inmunológico y los microbios son probablemente con los comensales en la piel, el intestino y las vías respiratorias. Por lo tanto, una respuesta inmunitaria que mantenga el status quo, en lugar de impulsar la eliminación bacteriana, que suele ir acompañada de inflamación y daño tisular, podría ser beneficiosa. Pero, ¿debe considerarse realmente que tal respuesta no es convencional? Aunque las funciones de las moléculas clásicas de MHC y de las células inmunitarias responsivas fueron identificadas en primer lugar, las proteínas no clásicas de MHC y proteínas tipo MHC son evolutivamente más antiguas que las moléculas MHC de clase Ia. Linehan y sus colegas revelan una relación directa entre el papel de las moléculas de MHC de clase Ib y la homeostasis tisular. Por lo tanto, estas funciones podrían haber evolucionado en paralelo y representan las funciones ampliamente `convencionales' del sistema inmunológico, con especializaciones adicionales a lo largo del tiempo.
El estudio sugiere posibles efectos amplios y a largo plazo de las bacterias residentes sobre el sistema inmunitario. Si los estudios futuros vinculan mecanísticamente los microorganismos individuales a tipos específicos de respuesta inmunitaria, podría ser posible no sólo comprender las funciones de algunas poblaciones abundantes y relativamente inexploradas de células inmunitarias, sino también determinar cómo afectan los microbios residentes a la salud de una manera que podría conducir a nuevos enfoques de tratamiento.
Fuente bibliográfica
Killer T cells show their kinder side.
Paul Klenerman and Graham Ogg
NIHR Biomedical Research Centre, Oxford OX1 3SY, UK.
DOI: 10.1038/d41586-018-03510-z