Escape bacteriano inducido por virus
Los microorganismos prosperan en las superficies de nuestro cuerpo. Las especies presentes no son sólo un conjunto aleatorio, sino una comunidad de organismos particularmente bien adaptados a las condiciones locales de temperatura, humedad, nutrientes y defensas del hospedero. Particularmente, Staphylococcus aureus es uno de nuestros residentes bacterianos más comunes. Generalmente vive en los tejidos nasales, respiratorios y reproductivos sin causar enfermedad, sin embargo, a diferencia de muchas otras bacterias residentes, el S. aureus tiene la capacidad de dar lugar a una infección potencialmente letal. Recientemente se ha reportado en modelos preclínicos que algunas cepas de S. aureus resistentes a los antibióticos, sufren una infección por virus bacterianos conocidos como fagos. El ADN del fago codifica una enzima llamada TarP que altera un componente de la pared bacteriana clave para el reconocimiento por parte del sistema inmune. Como consecuencia de esta alteración, se monta una respuesta inmune más débil lo que facilita la evasión del patógeno bacteriano de las defensas del huésped.
Bacteriófagos y evasión inmune
Durante los últimos 50 años, la resistencia de S. aureus a los antibióticos se ha convertido en un problema cada vez mayor, y las cepas de la bacteria llamada S. aureus resistente a la meticilina (SARM), que son resistentes a éste y otros antibióticos basados en penicilina metilada, causan infecciones adquiridas tanto en hospitales como en la comunidad en todo el mundo. En un reciente estudio Gerlach y colaboradores describen un mecanismo hasta ahora desconocido por el cual los virus determinan si el SARM es capaz de ser reconocido por el sistema inmunológico, lo que dilucida un proceso que podría inclinar la balanza para saber si esta bacteria será inofensiva o patogénica (DOI: 10.1038/s41586-018-0730-x).
El S. aureus pertenece al grupo de bacterias Gram positivas, y se ha descrito como un microorganismo que existe en el límite de ser un residente microbiano humano normal y uno causante de patologías. Esta bacteria parece tener la capacidad de detectar signos de debilidad del hospedero, como la reducción de las defensas inmunitarias causadas por enfermedad. Cuando esto es detectado, la bacteria puede aumentar su población a un nivel que puede causar la muerte del anfitrión. Los factores que regulan las interacciones huésped-microbianas son complejos, y además de las defensas del hospedador, estas interacciones pueden estar influenciadas por la presencia o ausencia de otras bacterias. Gerlach y sus colegas informaron que los virus también pueden ser parte de esta mezcla que influye en las relaciones huésped-microbianas en el contexto del SARM.
En las bacterias Gram-positivas, la pared celular contiene polímeros conocidos como ácidos teicoideos (WTA, por sus siglas en inglés), que están compuestos de moléculas de ribitol fosfato o glicerol fosfato y pueden constituir hasta la mitad de la masa de la pared celular bacteriana. A diferencia del otro componente principal de la pared celular, el peptidoglicano, que forma una malla porosa y comparativamente insoluble, los WTA forman un material altamente hidratado y gelatinoso que llena gran parte del espacio entre las hebras de peptidoglicano. El WTA proporciona una matriz soluble a través de la cual transitan todas las sustancias antes de llegar a la membrana celular de la nacteria, y por lo tanto afecta el acceso a los iones, nutrientes, proteínas y antibióticos. En S. aureus, el WTA se compone de unidades de d-ribitol fosfato, que están reticuladas con el peptidoglicano (figura 1). La función del WTA está sintonizada por los enlaces del aminoácido d-alanina y de las moléculas de N-acetilglucosamina (GlcNAc)7 al polímero ribitol fosfato.
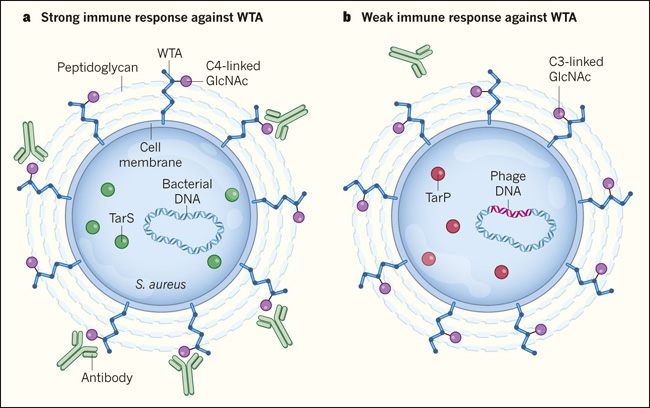
Figura. La infección viral de una bacteria puede alterar la respuesta inmune del huésped contra microbios.
a, La bacteria Staphylococcus aureus es residente del cuerpo humano. Su superficie externa está recubierta con capas del polímero peptidoglicano reticulado a los ácidos teicoides de pared (WTA) - polímeros de moléculas de ribitol fosfato. La enzima bacteriana TarS modifica el WTA, generando una forma que tiene la molécula GlcNAc unida a los átomos de carbono en la posición C4 en el ribitol. Los anticuerpos humanos contra S. aureus a menudo se dirigen al WTA. b, Gerlach y sus colegas (DOI: 10.1038/s41586-018-0730-x) informan que algunas cepas de S. aureus resistentes a los antibióticos, asociadas con condiciones difíciles de tratar, han sido infectadas con un virus llamado fago. El ADN del fago codifica una enzima llamada TarP (P del inglés phage) que une GlcNAc al WTA en átomos de carbono en la posición C3 del ribitol en lugar de la posición C4, lo normal. En estudios de ratones y de células humanas, los autores evidenciaron que el WTA modificado por TarP desencadena una respuesta inmune que es más débil que la respuesta contra WTA modificado por TarS.
Gerlach y sus colegas decidieron investigar si la evasión bacteriana de las defensas del sistema inmunológico podría ser una de las razones por las que las cepas de SARM pueden alcanzar un número suficientemente alto de bacterias como para causar enfermedad. Los autores estudiaron las secuencias genómicas de las cepas de SARM para identificar los genes que codifican las enzimas que modifican la WTA. Esto reveló que algunas cepas de SARM codifican una enzima llamada TarP que cataliza la adición de GlcNAc al d-ribitol fosfato, de un átomo de carbono particular (conocido como C3) en el ribitol. Normalmente, GlcNAc se añade en una posición diferente, el carbono C4, por la acción de una enzima relacionada llamada TarS.
Sorprendentemente, la secuencia de codificación TarP es de origen viral y se encuentra en S. aureus como resultado de la infección por un virus bacteriano llamado fago. El TarP es dominante sobre su contraparte bacteriana, el TarS, es decir, si ambas enzimas están presentes, el enlace GlcNAc se realiza en el carbono C3 del ribitol, en lugar del carbono C4. S. aureus normalmente se mantiene bajo control porque el sistema inmunitario tiene la capacidad de detectarlo. Sin embargo, los autores encontraron que, en ratones, es menos probable que la forma de WTA producida por la acción de TarP desencadene una respuesta inmunitaria que la forma de WTA generada por TarS.
Este cambio mediado por el virus en la pared celular de S. aureus reportado por los investigadores es importante por dos razones. En primer lugar, destaca el hecho de que una frágil tregua entre el huésped y el microbio residente pueda verse afectada por la intervención de una tercera parte con sus propios intereses creados. En segundo lugar, en un momento que algunos han llamado el comienzo de una "era post-antibiótica" -dado el aumento de bacterias resistentes a los antibióticos y el desarrollo limitado de nuevos antibióticos que llegan a la clínica- existe una necesidad urgente de desarrollar nuevas estrategias para manejar la infección.
Estamos en los albores de una era clínica en la que el objetivo será gestionar con precisión las interacciones humanas y microbianas para promover la salud y limitar las enfermedades. Los antibióticos seguirán desempeñando un papel clave, al igual que, sin duda, otros enfoques, como la sustitución de los microbios intestinales de una persona mediante técnicas como trasplantes fecales, o la eliminación mediada por fagos de microbios indeseables. La determinación del mejor enfoque se verá favorecida por el desarrollo de nuevas herramientas de diagnóstico y una comprensión más clara de la naturaleza de las interacciones humanas y microbianas. Si se decide adoptar un enfoque basado en una vacuna o posiblemente utilizar tratamientos con fagos en el futuro, las consideraciones clave incluirán saber cómo varía la susceptibilidad de una bacteria a la infección por fagos, y determinar si la presencia de ADN de fagos en un genoma bacteriano afecta la dinámica entre las células humanas y los microbios que colonizan el cuerpo.
Fuente bibliográfica
A bacterium’s enemy isn’t your friend
Michael S. Gilmore & Ona K. Miller
Departments of Ophthalmology and of Microbiology and Immunobiology, Harvard Medical School, Massachusetts Eye and Ear Infirmary, Boston, Massachusetts 02114, USA.
DOI: 10.1038/d41586-018-07414-w