Linfocitos rastreadores de tumores cerebrales
Dar instrucciones al sistema inmunitario para que reconozca y elimine tumores, un enfoque denominado inmunoterapia del cáncer, ha transformado el tratamiento clínico de ciertos tipos de neoplasias malignas. Entre estas terapias destacan los inhibidores de los puntos de control inmunológico, que bloquean la acción de proteínas que amortiguan las respuestas de células inmunitarias frente a los tumores. Por ejemplo, los anticuerpos pueden utilizarse para interferir con la proteína inhibitoria PD-1, presente en linfocitos T. Este enfoque se ha utilizado con más éxito para tratar melanomas, que están bien infiltrados por células T y que portan un gran número de mutaciones genéticas. Un subconjunto de estas mutaciones podría generar neoantígenos: una secuencia de proteínas alteradas que se producen de forma exclusiva en células cancerosas y que el sistema inmunitario reconoce como extrañas. Sin embargo, la mayoría de los cánceres, incluyendo los glioblastomas, no responden a la terapia de control inmunológico. Estos tumores no receptivos suelen tener un bajo nivel de mutaciones y expresan pocos neoantígenos. Por lo tanto, no logran atraer a las células T para infiltrarse en el tumor. Encontrar formas de reforzar la respuesta inmunitaria a estos tumores es un reto constante.
Vacunas de neoantígenos
En recientes estudios, Keskin y cols. (DOI: 10.1038/s41586-018-0792-9) y Hilf y cols. (DOI: 10.1038/s41586-018-0810-y) reportaron sus progresos y resultados de ensayos clínicos de fase I en los que se trató a personas con glioblastoma con una vacuna personalizada que contenía neoantígenos específicos para el tumor a nivel individual.
Keskin y sus colegas dieron a ocho personas que se habían sometido a cirugía para extirpar su tumor, y habían recibido radioterapia, una vacuna que contenía hasta 20 fragmentos de proteínas correspondientes a neoantígenos expresados en el tumor de la persona. Estos neoantígenos se eligieron analizando el material tumoral extraído durante la cirugía. El análisis de las muestras de sangre de las personas que habían sido vacunadas reveló entonces si los linfocitos T helper CD4+ y los linfocitos T citotóxicos CD8+ estaban respondiendo a estos neoantígenos.
Los autores encontraron que la vacuna no logró una respuesta robusta de células T en los participantes que también habían sido tratados con el medicamento dexametasona, inmunosupresor esteroide utilizado para reducir la inflamación cerebral. Las dos personas que no habían recibido dexametasona exhibieron una respuesta de células T específicas al neoantígeno que consistía predominantemente en células T CD4+ así como en linfocitos T CD8+. En particular, estas células T específicas del neoantígeno segregaron citoquinas implicadas en la destrucción de células tumorales. Estas dos personas tenían linfocitos T que expresaban proteínas de superficie conocidas por ser un sello distintivo de las células T que han adquirido el estado de memoria, una característica que permite una respuesta inmunitaria más rápida y robusta a un neoantígeno en particular si posteriormente reaparece. Sin embargo, todos los pacientes vacunados, incluso los dos que respondieron, finalmente murieron de cáncer.
Un hallazgo clave de este estudio se relaciona con los linfocitos T presentes en muestras extirpadas quirúrgicamente del crecimiento tumoral recurrente en uno de los tumores de los pacientes que respondieron al tratamiento. En este caso, las células T específicas del neoantígeno del tumor expresaron proteínas que indicaban que las células habían entrado en un estado disfuncional denominado agotamiento. Este estado corresponde a una disminución de la capacidad de reconocer y destruir las células cancerosas. Las células T agotadas a veces pueden ser revigorizadas usando inhibidores de los puntos de control inmunológico.
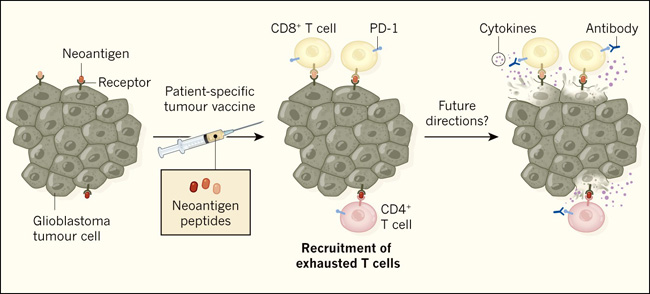
Figura 1. Uso de la inmunoterapia para tratar tumores cerebrales humanos.
Keskin y cols. (DOI: 10.1038/s41586-018-0792-9) y Hilf y cols. (DOI: 10.1038/s41586-018-0810-y) reportaron los resultados de ensayos clínicos de fase I que probaron formas de aumentar la respuesta inmunitaria contra los tumores de glioblastoma, difíciles de tratar con inmunoterapia. Ambos grupos intentaron potenciar las respuestas inmunitarias contra las versiones proteicas mutantes y específicas del tumor denominadas neoantígenos, que se exhiben unidas a los receptores de las células tumorales de una persona. Keskin y cols. dieron a los participantes vacunas que consistían en juegos personalizados de péptidos que coincidían con las secuencias de aminoácidos de sus neoantígenos específicos. Hilf y cols. combinaron esta vacuna personalizada con una que se dirige a proteínas no mutantes comunes a este tipo de tumor (no mostrado). Ambos estudios informan que la vacunación estimuló las respuestas inmunitarias que involucraban a las células T CD8+ y CD4+ que reconocían neoantígenos. Sin embargo, esto no previno la muerte asociada con el cáncer. Tal vez esto se deba a que las células T entraron en un estado disfuncional llamado agotamiento, según lo reportado por Keskin y colegas. La entrada en este estado puede estar mediada por una proteína receptora de la célula T llamada PD-1. Quizás futuros estudios comprueben si el bloqueo del agotamiento mediante el uso de anticuerpos dirigidos a PD-1 permite que las células T que se dirigen a un tumor permanezcan activas y secreten citoquinas que ayudan a la destrucción de las células tumorales.
Hilf y cols. probaron una estrategia que utilizaba dos tipos de vacunas. Una de ellas, similar a la utilizada por Keskin y sus colegas, consistió en una vacuna personalizada con neoantígeno. La otra, consistía en fragmentos de proteínas no mutadas correspondientes a proteínas asociadas a tumores presentes en las células cancerosas. Esta última vacuna no se personalizó para que coincidiera con las proteínas de cada individuo -las proteínas asociadas al tumor se identificaron mediante el análisis de 30 glioblastomas, utilizando técnicas para identificar las proteínas que están fuertemente asociadas a este tipo de tumor.
De 15 personas que se habían sometido a cirugía para extirpar su tumor y que recibían quimioterapia, 4 recibieron sólo la vacuna no personalizada y 11 recibieron ambas vacunas, administradas consecutivamente. Un par de personas inscritas abandonaron el ensayo. Un total de 13 individuos que habían recibido la vacuna no personalizada generaron una respuesta inmunológica que fue evaluada, y 12 de estos 13 individuos tenían linfocitos T CD8+ que podían reconocer al menos una proteína en la vacuna no personalizada. La vacuna personalizada indujo respuestas de células T CD4+ dirigidas a los neoantígenos en 8 de cada 10 personas que recibieron la vacuna personalizada y generaron respuestas inmunitarias que fueron evaluadas.
Los dos artículos muestran que es posible producir células T que ataquen algunos de los pocos neoantígenos expresados por los glioblastomas. Anteriormente se probaron enfoques similares de vacunas dirigidas a los neoantígenos en ensayos clínicos de fase temprana para el melanoma, que, a diferencia del glioblastoma, es un tipo de cáncer que tiene un alto nivel de mutaciones y neoantígenos.
Estos estudios de Keskin, Hilf y sus respectivos colegas destacan varios aspectos clave que destacan las limitaciones actuales de la terapia con vacunas personalizadas, así como los beneficios potenciales. Las personas con cáncer podrían estar recibiendo otros tratamientos, lo que podría limitar la efectividad de las vacunas de inmunoterapia, como fue observado por Keskin y colegas para los participantes que recibieron esteroides. Por el contrario, Hilf y sus colaboradores no informaron que las respuestas de las células T fueran afectadas por la quimioterapia recibida por los participantes en su estudio. Aunque el tamaño de la muestra en estos ensayos fue pequeño, los resultados sugieren que el momento de la administración de la vacuna debe considerarse cuidadosamente al diseñar futuros ensayos clínicos en los que se utilicen múltiples agentes inmunosupresores para el tratamiento.
Fuente bibliográfica
Immune cells track hard-to-target brain tumours
Neeha Zaidi &Elizabeth M. Jaffee
Sidney Kimmel Comprehensive Cancer Center, Johns Hopkins University School of Medicine, Baltimore, Maryland 21287, USA.
DOI: 10.1038/d41586-018-07728-9