Mecanismo antiopioide para una analgesia segura
Los opioides se dirigen al receptor μ para producir su potente efecto analgésico. Sin embargo, sus propiedades adictivas pueden llevar a un abuso severo. Recientemente se ha desarrollado una plataforma para estudiar de forma integral el comportamiento animal completo para el descubrimiento de genes que influyen en la capacidad de respuesta de los opioides. Usando técnicas de genética avanzada en Caenorhabditis elegans, investigadores lograron identificar un receptor acoplado a proteína G huérfano altamente conservado, GPR139, con actividad antiopioide. El GPR139 se coexpresa con el receptor μ en circuitos cerebrales sensibles a los opioides, se une al éste e inhibe la señalización de proteínas proteínas G. La eliminación de GPR139 en ratones mejoró la inhibición de la activación neuronal para modular la analgesia inducida por morfina, la recompensa y la abstinencia. Por lo tanto, el GPR139 podría ser un blanco útil para aumentar la seguridad de los opioides. Estos resultados también demuestran el potencial de C. elegans como plataforma escalable para el descubrimiento de los principios genéticos que regulan la señalización a nivel de receptor acoplado a proteína G.
GPR139
El gusano Caenorhabditis elegans es un organismo modelo simple pero potente: resulta útil para realizar pruebas genéticas rápidas en todo el genoma. En este modelo, las pruebas funcionales de alto rendimiento están diseñadas para detectar déficits fenotípicos específicos (por ejemplo, conductuales) después de realizar una inactivación -knockout- de miles de genes (lo que resulta en miles de gusanos, cada uno con un solo gen eliminado), después de lo cual se identifica el gen contribuyente a un determinado proceso o característica. Este pequeño nematodo ha sido instrumental en el descubrimiento de mecanismos moleculares de la función celular, en la caracterización de los linajes celulares del sistema nervioso y, más recientemente, en la comprensión de los trastornos del neurodesarrollo. Wang, Martemyanov y sus colegas describieron recientemente otro papel para C. elegans, identificando un determinante molecular clave de un comportamiento relevante para la medicina en el contexto de la creciente epidemia de los opioides (DOI: 10.1126/science.aau2078).
Los opioides como la morfina y el fentanilo producen sus fuertes efectos analgésicos y adversos (en particular, la depresión respiratoria y probabilidad de abuso) mediante la activación de un receptor acoplado a la proteína G (GPCR, por sus siglas en inglés) conocido como receptor de opioides mu. Wang y colaboradores descubrieron que el GPR139, un receptor escasamente descrito, interactúa con el receptor mu y actúa como freno para oponerse a los efectos analgésicos de los opioides. Por lo tanto, el bloqueo de GPR139 aumentaría la eficacia analgésica de los opioides medicinales y limitaría los efectos adversos, ya que se podrían administrar dosis más pequeñas.
El enfoque experimental de los autores muestra el poder de combinar una investigación genética en un organismo relativamente simple (el gusano) con enfoques conductuales sofisticados en el ratón. Su estudio se basa en la observación de que la expresión del receptor mu humano en C. elegans hace que el gusano responda al fentanilo: el organismo transgénico entra en una parálisis transitoria y luego reanuda la actividad motora normal a medida que el receptor mu se desensibiliza. Usando el gusano transgénico, Wang y sus colegas generaron aproximadamente 2.500 gusanos transgénicos mutados al azar. En conjunto, las mutaciones cubrieron aleatoriamente todo su genoma. Probaron cada organismo y recolectaron aquellos que se habían vuelto hipersensibles a los opioides por mutagénesis aleatoria, es decir, los gusanos que se paralizaban más rápidamente que los controles y que también mostraban una recuperación más rápida y que, por lo tanto, se escaparían más rápidamente de la zona de inicio del plato experimental. Un cribado primario (de 600.000 progenies mutantes) con el uso de morfina, seguido de un cribado secundario con el uso de fentanilo (para minimizar los falsos positivos), produjo 900 gusanos mutantes hipersensibles.
Centrándose en dos de los gusanos mutantes con características morfológicas normales, los autores mapearon las lesiones genéticas responsables de la hipersensibilidad. La primera mutación alteró el gen egl-19, que codifica un canal de calcio tipo L que se sabe que potencia los efectos analgésicos de los opioides en la clínica, mostrando así la validez de la prueba genética. La segunda mutación inactivó el gen frpr-13, que codifica una proteína ortóloga al receptor mamífero GPR139. Se sabe que este receptor se expresa predominantemente en el sistema nervioso. La alteración genética en frpr-13 en C. elegans resultó en una elevada actividad del receptor de opioides mu (figura 1A).
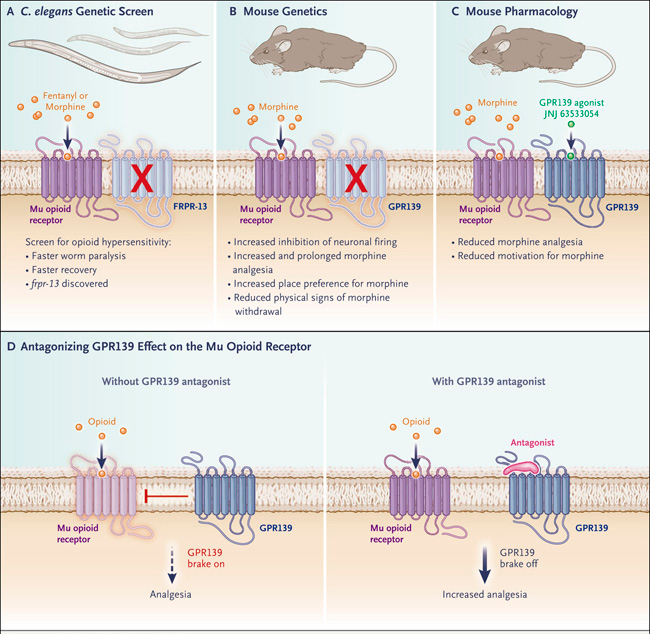

Figura 1. Efecto antipioide de GPR139.
Wang y sus colegas identificaron recientemente al receptor acoplado a proteína G 139 (GPR139) como un freno molecular en la actividad del receptor de opioides mu (también un GPCR). Los dos receptores se representan como siete dominios transmembrana, la estructura típica de estos receptores. Utilizando una pantalla de knockout en Caenorhabditis elegans, los investigadores encontraron que la pérdida de función de frpr-13 hace que los gusanos que expresan el receptor mu sean hipersensibles al fentanilo (panel A). De manera similar, los ratones que carecen del gen Gpr139, el homólogo mamífero, tienen un mayor efecto agonista sobre del receptor mu en el disparo neuronal, mayor analgesia y recompensa mediadas por morfina y menos síntomas de abstinencia física (por ejemplo, saltos, temblores y diarrea) (panel B). En contraste, la sobreexpresión de GPR139 en las células reduce la señalización del receptor mu, y la activación de GPR139 en ratones reduce los efectos analgésicos de la morfina, así como la autoadministración de morfina por parte de los ratones (panel C). Por lo tanto, el GPR139 muestra todos los rasgos distintivos de un receptor antiopioide, con implicaciones tanto para los efectos agudos como para los crónicos de los opioides (panel D). Un antagonista de GPR139 que pueda ser coadministrado con morfina sería ventajoso por dos razones: a corto plazo, el uso de un opioide para tratar el dolor podría reducirse, lo que se pronosticaría que reduciría la incidencia de efectos adversos del fármaco (depresión respiratoria, abuso y desarrollo de tolerancia); y en los pacientes con tratamiento prolongado, podría reducirse el aumento compensatorio esperado de la actividad de GPR139 para contrarrestar los efectos crónicos de los opioides en todo el sistema nervioso, lo que limitaría la dependencia física y los síntomas de abstinencia. Este mecanismo ha sido propuesto previamente para los sistemas antiopioides establecidos que involucran a otros GPCR, incluyendo los receptores de nociceptina / orfanina FQ, FRMFamida y colecistoquinina.
La caracterización de las interacciones entre el GPR139 y el receptor mu - y un antagonismo potencial entre los dos receptores - fue el siguiente paso lógico y extremadamente atractivo, porque los GRCP son susceptibles al desarrollo de medicamentos. De hecho, los GPCR constituyen la mayor familia de receptores de superficie celular. Perciben hormonas extracelulares, neurotransmisores e incluso señales de luz para impulsar la función celular y la comunicación en todo el organismo. Como tal, los GRCP son esenciales para la salud y la enfermedad y son el objetivo de aproximadamente el 40% de los medicamentos disponibles que se usan hoy en día en la clínica. Entre los varios cientos de GRCP que se sabe que están codificados en el genoma humano, aproximadamente 150 son considerados huérfanos, es decir, sus ligandos y funciones son prácticamente desconocidas. Aproximadamente 100 de estos GPCR se expresan en el cerebro, y cada una de ellas es un blanco potencial para los trastornos neuropsiquiátricos. GPR139 es una de ellas. Lo que se sabe sobre GPR139 es que es activado endógenamente por aminoácidos aromáticos, hormona adrenocorticotrópica, y péptidos relacionados con α- y β-MSH (hormona estimulante de melanocitos), y que tiene un papel en la transmisión de dopamina y en la adicción al alcohol. Además, es un objetivo factible para el desarrollo de fármacos y de hecho se han reportado varios productos químicos que se unen a GPR139 (DOI: 10.1111/bcpt.13263).
En la segunda parte del estudio, Wang y sus colegas desplegaron toda una armada de enfoques experimentales en mamíferos para investigar la actividad del GPR139 contra el receptor mu a nivel celular y sistémico. Los autores observaron una interacción física entre ambos receptores cuando estaban sobreexpresados en una línea celular humana, así como la inhibición de la señalización y el tráfico de los receptores mu mediada por GPR139. La inactivación de Gpr139 en ratones (análoga a la mutante de C. elegans) potenció la inhibición mediada por el receptor mu de la activación neuronal en la habenula media (que se sabe que promueve los estados aversivos) y en el locus ceruleus (implicado en la abstinencia de los opioides) -tejidos en los cuales se coexpresan los dos receptores-. Los ratones con Gpr139-nulo también exhibieron una mayor y prolongada analgesia por morfina, así como un mayor comportamiento consistente con la recompensa, mostrando que los efectos agudos de la morfina mejoraron cuando faltaba Gpr139. (Por el contrario, la activación de Gpr139 con un agonista de moléculas pequeñas redujo los efectos analgésicos de la morfina). Además, los signos somáticos de abstinencia se redujeron en ratones con Gpr139-nulo después de una exposición prolongada a la morfina. Esta observación sugiere que la actividad del GPR139 es uno de los principales contribuyentes a las neuroadaptaciones que compensan la estimulación crónica de los receptores mu y también contribuye a los síntomas de abstinencia cuando el opioide ya no está presente. Los hallazgos en ratones (figuras 1B y 1C) sugieren que un antagonista de GPR139 aumentaría la eficacia analgésica de los opioides medicinales y quizás incluso reduciría el desarrollo de la tolerancia y dependencia.
El trabajo de Wang y sus colegas introduce al receptor acoplado a proteína G 139 en un pequeño club de sistemas de péptidos y receptores antiopioides (figura 1D).3 Tales sistemas pueden contrarrestar la actividad de los receptores mu interactuando directamente con el receptor, amortiguando la señalización intracelular mediada por el receptor o actuando a nivel de sistemas (dentro de los circuitos cerebrales). Pueden hacerlo tanto a corto como a largo plazo. Se están realizando esfuerzos para bloquear los sistemas antiopioides y aumentar así los efectos de los opioides, pero los medicamentos que pueden lograrlo todavía no han llegado a la clínica. En este contexto, los hallazgos de los autores representan un avance significativo en la búsqueda de analgésicos opioides más seguros.
Fuente bibliográfica
An Anti-Opioid System, Courtesy of a Worm Model
Brigitte L. Kieffer, Ph.D.
Douglas Mental Health Institute, Department of Psychiatry, McGill University, Montreal.
NEJMcibr1911069