Metabolitos tumorales, obstáculos para reparar el ADN
Hacia finales del siglo XIX, las anomalías cromosómicas detectadas por microscopio óptico revelaron que en ciertos tipos de cáncer se produce una clase de inestabilidad masiva del genoma que da lugar a un número anormal de cromosomas. Poco después, el bioquímico Otto Warburg observó que las células tumorales tienden a utilizar rutas de metabolismo energético y de la glucosa que son distintas de las empleadas por células normales. Ahora sabemos que la inestabilidad del genoma y la alteración del metabolismo son dos características comunes de la mayoría de los tumores. La inestabilidad del genoma se ha investigado continuamente desde su descubrimiento, mientras que la alteración del metabolismo se redescubrió como área de investigación solo recientemente. A la fecha, no se ha reportado una interferencia entre estos dos procesos en el cáncer. Sin embargo, una reciente publicación muestra cómo varios metabolitos acumulados en células tumorales suprimen la reparación del ADN, revelando un vínculo directo entre la alteración metabólica y la inestabilidad genómica causada por el daño al ADN.
Hipermetilación genómica
Las mutaciones que afectan a los genes codificantes para las enzimas isocitrato deshidrogenasa 1 y 2 (IDH1 e IDH2) dan lugar a células que acumulan altos niveles del metabolito 2-hidroxiglutarato (2-HG). Las mutaciones en los genes que codifican las enzimas fumarato hidratasa y succinato deshidrogenasa hacen que las células acumulen fumarato y succinato, respectivamente. Estas tres moléculas pequeñas suelen denominarse oncometabolitos porque su acumulación estimula el desarrollo tumoral, y son estructuralmente similares a la molécula α-ketoglutarato (α-KG). Se trata de un intermediario en la vía del ciclo de Krebs que también sirve como componente, llamado co-sustrato, necesario para el funcionamiento de una familia de enzimas llamadas - dioxigenasas dependientes de α-KG/Fe(II).
Esta familia de enzimas, que comprende 65 miembros en los humanos, cataliza una diversa gama de reacciones de oxidación en las proteínas, el ADN, ARN y lípidos. En estas reacciones, α-KG se une al sitio activo de la enzima para ayudar a la catálisis. Sin embargo, el 2-HG, el succinato y el fumarato pueden competir con el α-KG por unirse a este sitio catalítico y así inhibir estas enzimas. Una de estas enzimas es la histona lisina demetilasa (KDM), que modifica la cromatina, el complejo de ADN y proteínas del que están hechos los cromosomas.
Dos KDMs estrechamente relacionadas, llamadas KDM4A y KDM4B, catalizan la eliminación de un grupo metilo de un residuo de aminoácido de lisina (llamado K9) en las proteínas de la histona 3 (H3) de unión al ADN en la cromatina. La metilación de H3K9 está vinculada a una vía llamada la vía de reparación dependiente de la homología (HDR), que repara las rupturas de doble hélice (DSB, del inglés double-strand breaks) en el ADN. Las DSB son el tipo de daño al ADN más peligroso. Si no se reparan, pueden causar rotura de cromosomas e inestabilidad genómica que podría promover el crecimiento de tumores o conducir a la muerte celular.
Sulkowski y sus colegas del Departamento de Genética de la Escuela de Medicina de la Universidad de Yale (Nature. 2020 Jun;582(7813):586-591) investigaron la HDR en células cancerígenas humanas cultivadas in vitro. Encontraron que, en un sitio de DSB, la adición local de tres grupos metilo a H3K9 para generar residuos de H3K9me3 trimetilado tiene un papel clave en la iniciación de esta clase de reparación dependiente de homología. En las células tumorales que tienen mutaciones en los genes que codifican IDH1, IDH2, fumarato hidratasa o succinato deshidrogenasa, los autores informan que los altos niveles de oncometabolitos inhiben la KDM4B. Esta inhibición de la desmetilación da lugar a una hipermetilación generalizada de H3K9 que enmascara el aspecto local específico de las marcas de H3K9me3 y perjudica el reclutamiento de los factores necesarios para la reparación vía HDR y DSB (figura 1).
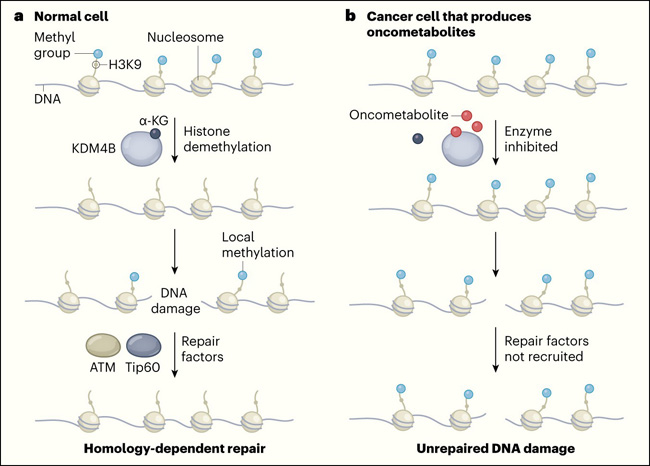
Figura 1. Cómo las moléculas de las células cancerosas inhiben la reparación del daño al ADN.
a, el ADN se envuelve alrededor de las histonas para formar una estructura llamada nucleosoma. En las células normales, la enzima KDM4B cataliza la eliminación de los grupos metilo del residuo de lisina 9 (K9) de la proteína histona 3 (H3) en el nucleosoma. Esta actividad de desmetilación de H3K9 requiere la pequeña molécula α-ketoglutarato (α-KG). Si se produce una ruptura de doble cadena en el ADN, la H3K9 se metila en el lugar del daño y esta señal de metilación local recluta factores de reparación del ADN que incluyen las proteínas Tip60 y ATM. Éstas corrigen el daño a través de un proceso llamado reparación dependiente de homología. b, Como resultado de ciertas mutaciones, algunas células cancerosas acumulan pequeñas moléculas llamadas oncometabolitos que promueven el crecimiento del tumor. Sulkowski y sus colegas han revelado un mecanismo que subyace a este fenómeno (Nature. 2020 Jun;582(7813):586-591). Los oncometabolitos compiten con α-KG por la unión a KDM4B y, por lo tanto, inhiben la función de la enzima. Esto da lugar a la metilación de H3K9 en todo el genoma. Esta hipermetilación global enmascara un pico local en la metilación de H3K9 que se produce después de un daño en el ADN, y dificulta el reclutamiento de factores de reparación. Los daños que no se reparan pueden conducir a la inestabilidad del genoma y, por lo tanto, impulsar el crecimiento de los tumores.
Anteriormente se había sugerido un vínculo entre los oncometabolitos y los defectos en la reparación del ADN al constatar clínicamente que las personas que tienen un tipo de cáncer llamado glioma con mutaciones en los genes IDH1 o IDH2 se beneficiaban de una combinación de quimioterapia y radioterapia, que inducen daños en el ADN. Ese hallazgo indica que los tumores que acumulan altos niveles de oncometabolitos son vulnerables a la terapia que causa daños en el ADN. Además, un análisis genómico de diferentes tipos de cáncer clasificó al IDH1 como el quinto gen humano más frecuentemente mutado y relacionado con la reparación del ADN.
Se han propuesto dos mecanismos para explicar cómo el 2-HG -que se acumula cuando existen mutaciones en IDH1 o IDH2- causa defectos de reparación del ADN. Una idea es que el 2-HG inhibe directamente las enzimas ALKBH2 y ALKBH3, que reparan el daño del ADN de una sola cadena inducido por la metilación. Otra sugerencia es que el 2-HG inhibe las demetilasas H3K9 y, por lo tanto, causa una reducción de la expresión de ATM, una proteína clave necesaria para la reparación.
Sulkowski y sus colegas habían encontrado previamente que los oncometabolitos suprimían la vía de la HDR y habían identificado a KDM4A y KDM4B como importantes para la reparación de las DSB. Por lo tanto, los autores exploraron las posibles conexiones entre estos procesos. La HDR es un evento complejo que implica el reclutamiento secuencial de múltiples factores de reparación en los sitios de DSB, con la proteína Tip60 entre las primeras en llegar a la región dañada. Los investigadores utilizaron un sistema en el que las células humanas cultivadas in vitro fueron diseñadas para permitir el inicio preciso de DSB y el monitoreo del proceso de reparación.
¿Cómo podría la inhibición de KDM4B por los oncometabolitos perjudicar la HDR? La metilación local de H3K9 activa la Tip60, que a su vez activa a ATM, una enzima clave necesaria para la HDR. Los resultados de una serie de experimentos apoyan el modelo de los autores de que un aumento repentino de las modificaciones de H3K9me3 en un sitio de DSB sirve como una señal para reclutar factores de reparación. El bloqueo de la acumulación de oncometabolitos, añadiendo α-KG, o células diseñadas para expresar KDM4A o KDM4B (pero no otras KDM o ALKBH2 o ALKBH3), resultó en una disminución de las modificaciones genómicas globales de H3K9me3 y restauró tanto el reclutamiento de factores de reparación como la reparación de DSB en un sitio de daño al ADN, en comparación con los efectos vistos en células que no recibieron tal tratamiento.
Los hallazgos de Sulkowski y sus colegas amplían las funciones conocidas de los oncometabolitos y plantean varias preguntas interesantes. ¿Cómo es que el rápido aumento de H3K9me3 en un sitio de DSB resulta en el reclutamiento coordinado de proteínas de reparación, y qué factor(es) podría(n) reconocer tal modificación de un sitio DSB? Alrededor del sitio DSB, ¿la hipermetilación de H3K9 -que se sabe que recluta factores represivos que impulsan la formación de una forma condensada de cromatina llamada heterocromatina- previene la unión de los factores necesarios para el HDR? También quedan preguntas sobre si los papeles de KDM4A y KDM4B difieren en la HDR. Ambas enzimas catalizan el mismo tipo de desmetilación de H3K9, y al potenciar su expresión pueden superar la inhibición de los oncometabolitos y prevenir los defectos del HDR. Sin embargo, los autores informan que solo el agotamiento de KDM4B afecta a la HDR.
La enzima PARP promueve la reparación de las rupturas de ADN de una sola cadena, y los inhibidores que bloquean a PARP se utilizan para tratar ciertos tipos de cáncer. Las células tumorales productoras de 2-HG son particularmente propensas a morir si se tratan con inhibidores de PARP. Por lo tanto, estos hallazgos podrían dar lugar a nuevas estrategias terapéuticas que aprovechen las oportunidades terapéuticas derivadas de la acumulación de oncometabolitos, dado que ahora tenemos un panorama más claro de la vulnerabilidad de esas células cancerosas si se atacan los procesos de reparación del ADN.
Fuente bibliográfica
Tumour metabolites hinder DNA repair
Lei-Lei Chen & Yue Xiong
Department of Biochemistry and Biophysics, and at the Lineberger Comprehensive Cancer Center, University of North Carolina at Chapel Hill, North Carolina 27516, USA.
Nature. 2020 Jun;582(7813):492-494