Mirada cromosómica de la evolución tumoral
Los errores de segregación cromosómica causan aneuploidía y heterogeneidad genómica, características distintivas del cáncer en humanos. Se predice que una persistente alta frecuencia de estos errores (inestabilidad cromosómica (INC)) impactará profundamente la evolución del tumor y la respuesta terapéutica. Sin embargo, se desconoce la prevalencia de la INC en tumores humanos. Mediante el cultivo tridimensional de organoides de células tumorales de pacientes, un estudio muestra que la INC está muy extendida en los carcinomas colorrectales, independientemente de las alteraciones genéticas de fondo, incluida la inestabilidad microsatélite. El seguimiento del destino celular mostró que, aunque los errores mitóticos son frecuentemente seguidos por muerte celular, algunas células tumorales son en gran medida insensibles a los errores mitóticos. La secuenciación de cariotipos unicelulares confirmó la heterogeneidad de las alteraciones del número de copias y además demostró que las líneas monoclonales originan nuevos cariotipos con el tiempo bajo condiciones in vitro. Por lo tanto, se concluye que la inestabilidad cromosómica en curso es común en los organoides del cáncer colorrectal, y se propone que los niveles de INC y la tolerancia a los errores mitóticos conforman el panorama de la aneuploidía y de la heterogeneidad del cariotipo.
Seguimiento a los cromosomas
Los genomas de células cancerosas están llenos de mutaciones (por errores en nucleótidos individuales), algunos de los cuales podrían contribuir al crecimiento del cáncer al activar genes promotores de tumores llamados oncogenes, o al desactivar genes pertenecientes a una clase conocida como supresores de tumores, que combaten el cáncer. Sin embargo, aún más importantes son las anomalías genómicas que se producen en células tumorales a una escala mucho mayor. Por ejemplo, una célula de este tipo podría contener números anómalos de cromosomas enteros (una situación llamada aneuploidía). A medida que el tumor evoluciona, las anomalías cromosómicas pueden variar entre las células cancerosas vecinas. Esto sugiere que los cambios cromosómicos pueden ocurrir por la repetición del "barajar" cromosómico durante cada división celular, resultando en una alta tasa de cambio genómico, llamada inestabilidad cromosómica.
Las dificultades técnicas para analizar las células recién aisladas de los tumores han impedido previamente a los investigadores determinar si existe una inestabilidad cromosómica continua en los tumores. Sin embargo, en un reciente estudio Ana C. F. Bolhaqueiro y colaboradores reportan tales datos, revelando la continua inestabilidad cromosómica en las células de cáncer colorrectal humano (DOI: 10.1038/s41588-019-0399-6).
Se sabe desde hace más de 20 años que las células de la mayoría de los cánceres colorrectales varían en el número de sus cromosomas, y esto se ha atribuido a la inestabilidad cromosómica. Cerca del 90% de los tumores sólidos tienen algún grado de inestabilidad cromosómica. Se cree que esta alteración continua del genoma de una célula tumoral ayuda a la rápida adaptación a las terapias contra el cáncer. Un alto nivel de alteración genómica se correlaciona a menudo con un mal pronóstico para las personas que tienen cáncer. Por lo tanto, existe un gran interés en obtener una imagen clara de la inestabilidad cromosómica, por ejemplo, determinando los mecanismos responsables, la velocidad a la que se producen dichos cambios y cómo evoluciona en un tumor individual.
Sin embargo, dado que la inestabilidad cromosómica es un proceso dinámico, no puede evaluarse adecuadamente solo a partir de las "instantáneas" aisladas de perfiles de ADN de un genoma tumoral que suelen estar disponibles. Hasta ahora, gran parte de la columna vertebral del trabajo de laboratorio que ilumina las tasas y los mecanismos implicados se ha basado en experimentos en los que células que se han extraído de tumores se cultivan en placas, generalmente en forma de monocapa 2D, y dichas células se mantienen a menudo en cultivo durante muchos años.
No está claro hasta qué punto son representativos estos sistemas de modelos 2D de tumores que crecen en su entorno nativo. Los sistemas de cultivo celular que pueden permitir el crecimiento tridimensional, como el uso de grupos de células llamados organoides, han sido pioneros en reflejar los entornos tumorales con mayor precisión. De hecho, cuando la arquitectura normal del tejido que rodea a las células no cancerosas se pierde al cultivar las células en una monocapa 2D, esto puede bastar para promover la división celular propensa a errores. Sin embargo, no se producen divisiones celulares anormales si las células se cultivan como organoides.
Para estudiar la inestabilidad cromosómica en células vivas, Bolhaqueiro y sus colegas aislaron muestras de células tumorales colorrectales humanas y las cultivaron directamente como organoides. Mediante ingeniería genética, los autores expresaron una proteína de unión al ADN fluorescente en las células, y pudieron obtener imágenes en vivo para evaluar el comportamiento cromosómico durante la división celular (figura 1). También realizaron secuenciamientos periódicos de ADN unicelular para rastrear los cambios en el número y estructura cromosómica (el orden de las secuencias de ADN en los cromosomas) a lo largo del tiempo.
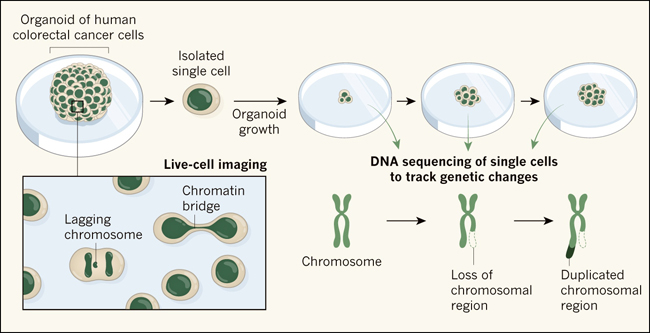
Figura 1. Seguimiento de los cambios cromosómicos en el cáncer colorrectal humano.
La aparición de anomalías cromosómicas en el cáncer colorrectal se asocia con un pronóstico deficiente, y la comprensión de cómo se producen estos cambios en las células vivas podría revelar dianas para el desarrollo de fármacos. Ana C. F. Bolhaqueiro y colaboradores estudiaron muestras de células de cáncer colorrectal humano que habían sido cultivadas in vitro como un grupo de células 3D llamado organoide. La expresión de una proteína de unión al ADN fluorescente permitió utilizar la microscopía para obtener imágenes del material genético (verde) a medida que las células cancerosas se dividían. Esto proporcionó información sobre los errores de división celular que se producían, como que un cromosoma se separase del resto a medida que se dividía una célula, lo que se denomina cromosoma retardado (inset). Las anomalías cromosómicas más comunes observadas fueron estructuras llamadas puentes de cromatina, que son regiones de ADN formadas a partir de cromosomas que se han fusionado. Los autores también realizaron experimentos en los que aislaron una sola célula del organoide y la utilizaron para cultivar otro organoide. Mediante la realización periódica de secuenciación del ADN unicelular de este organoide en crecimiento, las alteraciones cromosómicas, como deleciones o duplicaciones de regiones cromosómicas, pueden rastrearse con el tiempo.
Los investigadores encontraron que la división de las células cancerosas frecuentemente cometía errores en la división de los cromosomas entre las células hijas, confirmando los resultados obtenidos previamente utilizando sistemas 2D. No observaron tales errores en los organoides hechos de tejido sano del colon, lo que indica que el sistema experimental en sí mismo no desencadena tales errores. Estos defectos de partición eran indicativos de un proceso continuo de inestabilidad cromosómica. Los autores probaron si este era el caso estudiando los organoides derivados de una célula tumoral única que fue monitoreada a medida que el organoide crecía y evolucionaba (figura 1). La secuenciación del ADN unicelular en diferentes momentos durante este experimento confirmó que había una inestabilidad cromosómica continua.
En el pasado ha sido difícil evaluar los mecanismos que generan esta inestabilidad en un entorno nativo. El modelo organoide de Bolhaqueiro y sus colegas es una representación más cercana posible de eso. Los autores observaron que la mayoría de los errores de división cromosómica surgieron de la formación de puentes de cromatina, en los que un cromosoma, o parte de uno, se estira entre las dos masas de separación del ADN celular en la fase final de la división celular. Tales errores son indicativos de cambios estructurales durante la replicación cromosómica que ocurren antes de la división celular, y se han observado en mono-capas 2D de células cancerosas colorrectales.
Actualmente, existe mucho debate sobre la causa de la inestabilidad cromosómica en el cáncer. Los puentes de cromatina podrían surgir como resultado de otros defectos en los procesos de división celular, y análisis más profundos utilizando modelos de organoides para investigar la naturaleza específica de tales defectos de división cromosómica, y cualquier otro proceso anormal de división celular podría arrojar luz sobre los mecanismos involucrados.
Fuente bibliográfica
Watching cancer cells evolve through chromosomal instability
Sarah C. Johnson & Sarah E. McClelland
Barts Cancer Institute, Queen Mary University of London, London EC1M 6BQ, UK.
DOI: 10.1038/d41586-019-01709-2