Proteínas silenciadoras de genes virales
Los retrovirus codifican su huella genética en forma de ARN. Cuando estos virus entran en una célula huésped, una enzima viral genera una versión de ADN de esta secuencia de ARN que puede integrarse permanentemente en el genoma celular, a pesar de los esfuerzos la célula para evitar este resultado. El silenciamiento génico proporciona una forma vigorosa de defensa del huésped contra el ADN viral que llega al núcleo pero que no se integra con éxito en el genoma. Sin embargo, este mecanismo es poco conocido. Este silenciamiento puede limitar los enfoques de la terapia génica que utiliza retrovirus no integrados. Un reciente estudio revela que la proteína NP220, conservada evolutivamente, tiene un papel central en el silenciamiento de la transcripción de retrovirus no integrados.
Proteína NP220
Cuando el ADN retroviral no integrado entra en el núcleo de la célula huésped, se une rápidamente a las proteínas histonas, que empaquetan el ADN, lo que sugiere que las secuencias retrovirales están sujetas a regulación incluso antes de que se produzca cualquier intento de integración. Para identificar los factores del huésped que podrían mediar el silenciamiento del ADN retroviral no integrado, Zhu y cols (DOI: 10.1038/s41586-018-0750-6) utilizaron la técnica de edición genética CRISPR-Cas9. Esto permitió a los autores eliminar la expresión de genes individuales a través de todo el genoma de células humanas cultivadas in vitro y probar el efecto de esto en el silenciamiento de los genes virales.
Los resultados experimentales llevaron a los autores a centrarse en cinco proteínas celulares. Una fue la proteína de unión al ADN, NP220, que se encuentra en el núcleo. Otras tres proteínas de interés - MPP8, TASOR y PPHLN1 - forman una estructura multiproteica llamada complejo HUSH que se ha asociado previamente con el mantenimiento del estado latente del VIH integrado, y en contribuir al silenciamiento de las secuencias retrovirales integradas llamadas retroelementos. La quinta proteína fue SETDB1, una enzima metiltransferasa que puede modificar las histonas e interactuar con el complejo HUSH para bloquear la transcripción del ADN retroviral recientemente integrado.
Los autores analizaron la función de cada una de estas proteínas en células humanas cultivadas in vitro infectadas con el virus de la leucemia murina, un retrovirus modelo que se utilizó en los primeros intentos de terapia génica retroviral. Encontraron que NP220 se une al ADN retroviral no integrado (figura 1) y, al hacerlo, recluta al complejo HUSH. Este complejo entonces recluta a SETDB1 para depositar modificaciones de metilo en proteínas histónicas unidas al ADN viral. Estas modificaciones están asociadas con la supresión de la expresión génica. Zhu y sus colegas también descubrieron que NP220 recluta dos enzimas, llamadas HDAC1 y HDAC4, de una familia de enzimas llamadas histonas deacetilasasas, que catalizan la eliminación de los grupos acetilo de las histonas. Una disminución en el nivel de acetilación de la histona puede reprimir la expresión génica.
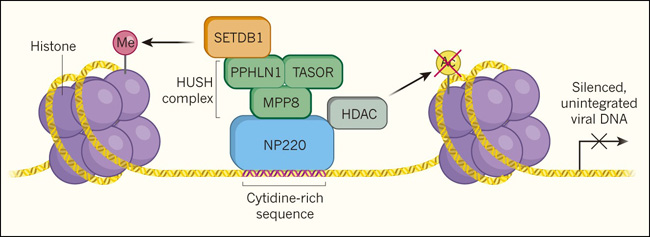
Figura 1. Un complejo proteico que suprime la expresión de genes virales.
Zhu y cols. (DOI: 10.1038/s41586-018-0750-6) investigaron cómo las células humanas silencian la expresión génica del ADN viral que no está integrado en el genoma celular. Los autores informan que las regiones de ADN viral que son ricas en citidina, están unidas por la proteína de unión al ADN, NP220. Esta proteína está asociada con las proteínas PPHLN1, TASOR y MPP8 que forman el complejo HUSH (verde). Otra proteína asociada con este grupo es la enzima SETDB1, que puede añadir grupos metilos (Me) a las proteínas histónicas que empaquetan el ADN viral. Este tipo de modificación de histona generalmente ayuda a silenciar la expresión génica. La eliminación de los grupos acetilo (Ac) en las histonas también reprime la expresión génica. Los autores informan que las enzimas histona deacetilasa (HDAC) que catalizan la eliminación de estos grupos acetilo se encuentran asociadas con NP220.
Los autores probaron el efecto del agotamiento de NP220 o HDAC1 y HDAC4 en células humanas infectadas con diferentes retrovirus. Por ejemplo, analizaron el VIH, que pertenece a un género de retrovirus diferente al del virus de la leucemia murina, y descubrieron que el agotamiento de estos componentes causaba un aumento en la expresión génica a partir del retrovirus no integrado. Sin embargo, el agotamiento de los componentes del complejo HUSH o SETDB1 no causó una mayor expresión de la secuencia viral no integrada en este escenario. Un patrón similar de resultados se obtuvo cuando los autores realizaron el mismo tipo de estudio utilizando el virus del mono Mason-Pfizer, que pertenece a otro género de retrovirus. Esto sugiere que el papel de NP220 se conserva evolutivamente, pero que las proteínas que podrían actuar con NP220 para silenciar la expresión génica viral pueden variar dependiendo del retrovirus.
NP220 puede unirse a secuencias en el ADN de doble hebra ricas en nucleósidos de citidina. Zhu y sus colegas informan que hay regiones ricas en citidina en secuencias repetidas llamadas repeticiones terminales largas (LTR) en los extremos de las secuencias del virus de la leucemia murina, el VIH y el virus del mono Mason-Pfizer, y que estas secuencias LTR ricas en citidina pueden servir como sitios de unión para NP220. Cuando los autores analizaron el efecto del agotamiento del NP220 en células humanas infectadas con el virus del sarcoma de Rous (de otro género de retrovirus), que tiene LTRs pobres en citidina, este agotamiento no afectó la expresión génica del ADN viral no integrado. Esto sugiere que el NP220 necesita secuencias de ADN ricas en citidina para unirse y silenciar los genes virales. Sin embargo, se descubrió que el silenciamiento de la expresión génica del ADN viral no integrado del sarcoma de Rous independiente de NP220 si dependía de SETDB1 porque la eliminación del gen que codifica el SETDB1 condujo a un aumento de la expresión génica del ADN viral. Sería interesante saber más sobre cómo se silencia el virus del sarcoma de Rous no integrado a través de este mecanismo independiente de NP220. En conjunto, estos estudios revelan que NP220 o sus socios interactivos pueden silenciar el ADN no integrado de una serie de retrovirus.
Las proteínas HUSH y SETDB1 participan en el silenciamiento transcripcional de los elementos retrovirales integrados. Queda por determinar si NP220 también actúa para silenciar la expresión del ADN retroviral integrado. Esta es una posibilidad, dado que los motivos de unión ricos en citidina para el NP220 se conservan en las LTR virales después de su integración en un genoma huésped. Claramente, hay más que investigar sobre el mecanismo de silenciamiento descubierto por Zhu y sus colegas.
Fuente bibliográfica
How cells hush a viral invader
Parinaz Fozouni & Melanie Ott
Gladstone Institutes, San Francisco, and in the Department of Medicine, University of California, San Francisco, California 94143, USA.
DOI: 10.1038/d41586-018-07493-9