Sinapsis potenciadoras del cáncer
Recientes investigaciones muestran que un canal de comunicación directa entre neuronas y células de glioma en diferentes modelos de enfermedad y tumores humanos: sinapsis químicas entre neuronas presinápticas y células de glioma postsinápticas. Estas sinapsis neurogliómicas exhiben una estructura sináptica típica, se localizan en microtubos tumorales (proyecciones citoplasmáticas compuestas de uniones comunicantes tipo gap) y producen corrientes postsinápticas mediadas por receptores de glutamato del subtipo AMPA. Como se sabe, la actividad neuronal, incluidas las condiciones epilépticas, genera flujos transitorios de calcio sincronizados en las redes de gliomas conectados por microtubos tumorales. La perturbación genética específica de los receptores AMPA reduce la invasividad relacionada con la despolarización mediada por calcio de las células tumorales y el crecimiento del glioma. La invasión y el crecimiento también se reducen, respectivamente con la anestesia y el antagonista del receptor AMPA perampanel. Estos hallazgos revelan una comunicación sináptica directa biológicamente relevante entre las neuronas y las células del glioma con implicaciones clínicas potenciales.
Vínculos peligrosos
Las personas con tumores cerebrales tienen una serie de síntomas que pueden variar en gravedad, desde dolores de cabeza hasta una disminución de la función cognitiva. La sintomatología depende del tipo de tumor y de su tamaño, localización y tasa de crecimiento. Entender qué controla la tasa de crecimiento de los tumores cerebrales podría, por lo tanto, conducir al desarrollo de terapias que retrasen la progresión del cáncer y mejoren la calidad de vida de las personas. Recientemente, tres grupos de investigadores independientes informan que, en el cerebro, las neuronas y las células cancerosas forman un tipo de conexión -sinapsis excitatoria- y la formación de ésta, estimula el crecimiento tumoral.
Una sinapsis excitatoria es una estructura en la que dos neuronas adyacentes -llamadas neuronas presinápticas y postsinápticas- se comunican mediante una molécula neurotransmisora, generalmente glutamato (figura 1). La liberación de glutamato por la neurona presináptica activa los receptores de glutamato, conocidos como receptores AMPA y receptores NMDA, en la terminal postsináptica. La activación del receptor causa movimiento iónico a través de la membrana celular, lo que produce despolarización - un aumento de la carga positiva dentro de la neurona postsináptica que conduce a la excitación. Ciertas células cerebrales no neuronales llamadas glía rodean una sinapsis y regulan la transmisión de la señal a través de ella eliminando el neurotransmisor liberado. Otros tipos de células gliales afectan la excitabilidad neuronal (la facilidad con la que se despolarizan las neuronas) al regular los iones de potasio extracelulares.
Las células gliales pueden dar lugar a un tipo de tumor cerebral llamado glioma, que es la principal causa de muerte por cáncer cerebral en Estados Unidos. Una característica común entre muchos tipos diferentes de glioma es que su crecimiento requiere la actividad de células neuronales vecinas, pero la razón no se ha comprendido completamente hasta ahora.
Las células gliales sanas forman redes celulares interconectadas. Esto se debe a que las estructuras de la membrana de la célula glial, llamadas uniones en hendidura (gap junction) permiten que las moléculas de señalización, como los iones de calcio, se trasladen a las células gliales vecinas. Las células de glioma también crean redes celulares interconectadas formando uniones gap en los llamados microtubos tumorales, que son protuberancias largas y delgadas de la membrana celular que se extienden desde estas células hasta el tejido circundante y que contribuyen a la infiltración y proliferación del tumor.
Usando microscopía electrónica, Venkataramani y sus colegas examinaron microtubos tumorales formados por gliomas humanos que habían sido transplantados en cerebros de ratones (Nature. 2019 Sep;573(7775):532-538). Observaron que los microtubos tenían estructuras características de sinapsis excitatorias, llamadas densidades postsinápticas, donde normalmente están presentes los receptores de glutamato. Adyacentes a estas densidades postsinápticas, en una neurona cercana, los autores observaron grupos de vesículas que almacenan moléculas neurotransmisoras, que son una característica de una zona presináptica neuronal. Un segundo grupo de investigadores compuesto por Venkatesh y colaboradores hicieron observaciones similares de las estructuras sinápticas que surgen entre las células de glioma y las neuronas (Nature. 2019 Sep;573(7775):539-545).
Ambos grupos de investigadores proporcionan evidencia de que los genes que codifican los receptores de glutamato y los componentes estructurales de la región postsináptica se expresan en un subconjunto de células en gliomas humanos, lo que sugiere que estas células tumorales explotan los mismos mecanismos moleculares utilizados por las neuronas para establecer sinapsis. Para determinar si las sinapsis entre las células tumorales y las neuronas funcionan de forma similar a las que se forman entre neuronas, ambos grupos trasplantaron células de glioma humano al cerebro de un ratón. La estimulación de las neuronas cerca de las células de glioma produjo una corriente despolarizante rápida en algunas células tumorales, características de las sinapsis excitatorias, y esta corriente fue mediada por receptores AMPA. Crucialmente, el tipo de receptor de AMPA expresado en estas células de glioma tiene diferentes propiedades farmacológicas que los receptores de AMPA expresados en la neurona, lo que lo convierte en un candidato prometedor como diana terapéutica. En algunas de las otras células de glioma, se observó una corriente despolarizante de larga duración que se amplificó y se extendió a través de intersecciones a la red conectada de células tumorales. Esta corriente prolongada no era de origen sináptico, sino que parecía provenir de cambios en la concentración extracelular de iones de potasio como resultado de la actividad neuronal.
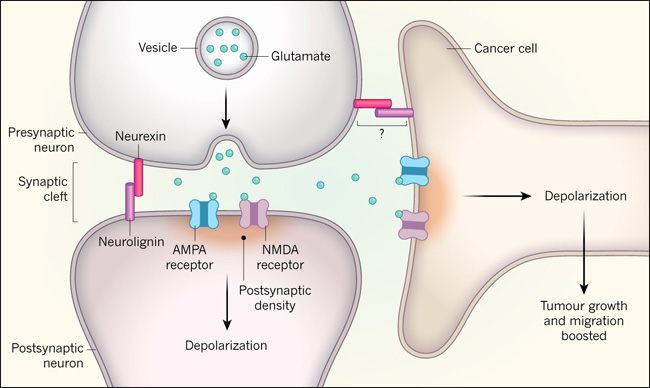
Figura 1. Las células cancerosas forman conexiones sinápticas con las neuronas.
Las sinapsis permiten la comunicación entre las neuronas. Las proteínas de adhesión celular como las neurexinas y las neuroliginas ayudan a que se formen sinapsis entre las neuronas. En la comunicación neuronal a través de una sinapsis, la molécula neurotransmisora (típicamente glutamato) se almacena en vesículas y se libera de la terminal presináptica. El glutamato atraviesa la hendidura sináptica para unirse y activar los receptores AMPA y NMDA en una estructura que se encuentra en la neurona postsináptica llamada densidad postsináptica. La activación de estos receptores de glutamato hace que los iones cargados positivamente (no mostrados) entren en la célula a través de los receptores, causando despolarización: un aumento de la carga positiva intracelular. Los grupos independientes de investigadores liderados por Venkataramani y cols. y Venkatesh y cols. reportan que las células cancerosas humanas crecidas in vitro o transplantadas en cerebros de ratones formaron sinapsis funcionales con las neuronas. La activación de estas sinapsis entre las células cancerosas y las neuronas se asoció con la colonización del cerebro, la migración de células cancerosas y la proliferación tumoral, lo que ayuda a explicar por qué la actividad neuronal es necesaria para el crecimiento del cáncer cerebral. Quizás la neuroligina ayuda a la formación de sinapsis entre las células cancerosas y las neuronas. Se desconoce dónde podría actuar, y si se une a la neurexina, en tales sinapsis.
La despolarización de las células de glioma inducida por la actividad neuronal causó un aumento transitorio de los iones de calcio en el citoplasma, que luego se propagaron a través de la red de células de glioma a través de sus uniones gap. Una mayor frecuencia de estas señales de calcio se correlacionó con una mayor migración de algunas de las células tumorales de la red, lo que indica que la formación de sinapsis en una célula tumoral alteró las propiedades de otras células de la red tumoral y aumentó su capacidad de invasión.
Para determinar la importancia biológica de las sinapsis formadas entre las células de glioma y las neuronas en sus sistemas modelo, en las investigaciones de Venkatesh y Venkataramani se utilizaron ya sea herramientas farmacológicas o células de glioma genéticamente modificadas para bloquear los receptores AMPA y así prevenir las despolarizaciones inducidas por la actividad sináptica. Estos tratamientos condujeron a un aumento en el tiempo de supervivencia de los animales que habían recibido un trasplante de células de glioma humano, en comparación con los animales control en los que los receptores de AMPA no estaban bloqueados. Estas manipulaciones de la función del receptor AMPA causaron, por lo tanto, una reducción sustancial del efecto de la estimulación sináptica sobre la proliferación y la capacidad invasora de las células gliomatosas.
Ambos grupos también diseñaron células de glioma humano para expresar una versión activable por luz de un canal de iones que produce despolarización celular, similar a la obtenida por la activación mediada los receptores de glutamato. Tales células fueron transplantadas al cerebro de los ratones por Venkatesh y colaboradores o cultivadas in vitro por Venkataramani y sus colegas. Cuando se utilizaba la luz para despolarizar las células de glioma, esto promovía la proliferación tumoral.
La evidencia aportada por estas investigaciones indica que algunas células de glioma tienen la capacidad de formar sinapsis funcionales con neuronas que están presentes en su microambiente. Además, estas células forman un tejido eléctricamente activo que puede enviar señales a otras células de glioma de la red de células tumorales para promover su migración y crecimiento. La presencia de sinapsis funcionales entre las neuronas y las células cancerosas explica por qué la neurotransmisión mediada por glutamato está asociada con una mayor proliferación, supervivencia e invasividad de las células de glioma.
En suma, estos estudios demuestran que los tumores cerebrales pueden establecer conexiones sinápticas con las neuronas utilizando el kit de herramientas moleculares que forma sinapsis entre neuronas. En las neuronas, la actividad sináptica permite la despolarización y la afluencia de iones de calcio necesarios para la diferenciación, proliferación y supervivencia celular. En las células cancerosas, estos mismos procesos apoyan la proliferación del tumor y contribuyen a la eventual letalidad del cáncer. Estos intrigantes hallazgos plantean la posibilidad de que los enfoques dirigidos a tipos específicos de receptores de glutamato, procesos de señalización postsináptica o los mecanismos necesarios para la formación de sinapsis puedan proporcionar dianas terapéuticas para retardar la proliferación tumoral.
Fuente bibliográfica
Dangerous liaisons as tumour cells form synapses with neurons
Andres Barria
Department of Physiology & Biophysics, University of Washington, Seattle, Washington 98195, USA.
Nature 573, 499-501 (2019)