Tratamiento de la enfermedad de Crohn bajo la lupa
El bloqueo de la subunidad p19 de la interleuquina-23, conseguido con el anticuerpo risankizumab, se perfila como una estrategia prometedora contra la patología avanzada. No obstante, es crucial diversificar los participantes en estudios futuros para optimizar la selección de la terapia.
La interleuquina-12 (IL-12) e interleuquina-23 (IL-23) desempeñan un papel crucial en la homeostasis y la inflamación intestinal, compartiendo características clave, como la subunidad p40, la subunidad del receptor interleuquina-12Rβ1, y las moléculas de señalización JAK y STAT que comunican funciones río abajo (figura 1). La Administración de Alimentos y Medicamentos (FDA) ha aprobado terapias que inhiben la subunidad común p40 de la IL-12 o la subunidad p19 específica de la IL-23 para el tratamiento de la enfermedad de Crohn.
La elección de la terapia más eficaz ha generado un gran interés y especulación. En el ensayo SEQUENCE, dirigido por el Dr. Peyrin-Biroulet del Centro Hospitalario Regional Universitario de Nancy en Francia, se realizó un estudio comparativo para evaluar la eficacia y seguridad de risankizumab (que bloquea la subunidad p19 de la IL-23) frente a ustekinumab (que bloquea la subunidad p40 de la IL-12) en pacientes con enfermedad de Crohn.
Los estudios preclínicos iniciales identificaron un aumento de las células T colaboradoras 1 (Th1) inflamatorias, lo que llevó a pensar que estas células desempeñaban un papel predominante en el trastorno. La IL-12 participa en la diferenciación de las células T en células Th1 (figura 1). La terapia con anticuerpos monoclonales neutralizantes anti-IL-12 p40 en pacientes con esta enfermedad redujo los niveles de células Th1 en el intestino y disminuyó la inflamación. Sin embargo, cuando se descubrió que la IL-12 p40 también podía asociarse con la IL-23 p19 para formar IL-23, surgió la necesidad de reevaluar si los efectos beneficiosos del bloqueo de IL-12 p40 en la inflamación intestinal eran atribuibles a la IL-12, a la IL-23 o a la acción combinada de ambas citoquinas. La IL-23, por su parte, expande y mantiene las células Th17, especialmente en las superficies mucosas, y estas células se encuentran aumentadas en los tejidos intestinales de pacientes con la enfermedad.
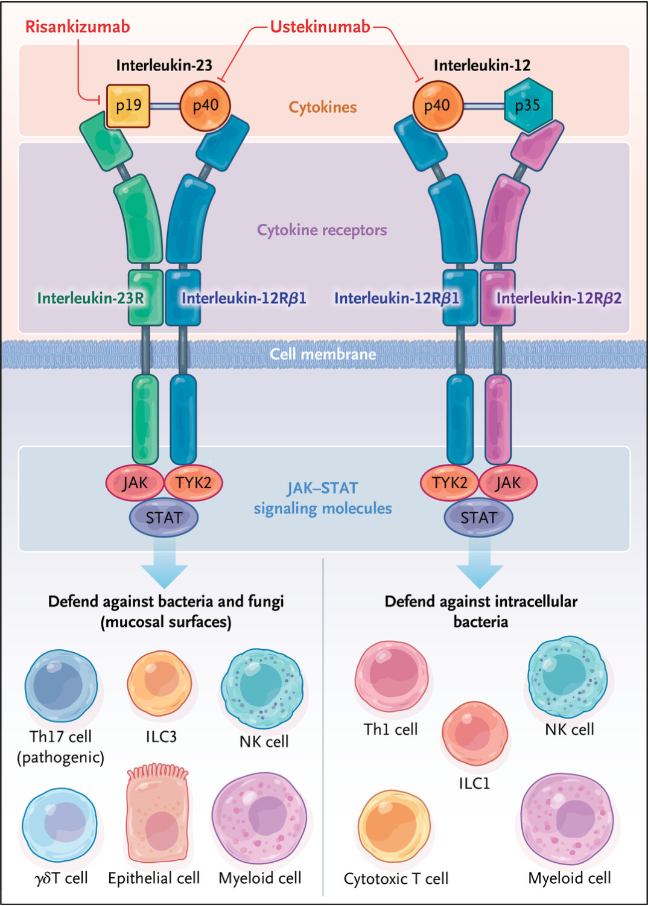
Figura 1: interleuquina-23 e interleuquina-12
Dado que la enfermedad de Crohn implica la desregulación de las células Th1 y Th17, muchos investigadores plantearon que reducir ambos subconjuntos mediante la inhibición de la subunidad compartida p40 de la IL-12 podría mejorar los resultados, ya que estas células se regulan mutuamente. Estudios preclínicos respaldaron esta hipótesis, mostrando que bloquear IL-12 p40 ofrecía mayores beneficios en la reducción de la inflamación sistémica que el bloqueo de IL-23 p19. Sin embargo, algunos sugirieron que inhibir selectivamente IL-23, preservando las funciones protectoras de IL-12 y Th1, podría ser más efectivo. Aunque bloquear solo IL-12 no redujo la inflamación intestinal, lo que sugiere un papel clave de IL-23, se demostró que el bloqueo de IL-17, una citoquina producida por Th17 dependiente de IL-23, empeoraba la enfermedad. Estudios en animales indicaron que la IL-17 no desaparece por completo cuando se bloquea IL-23, probablemente debido a otros subconjuntos celulares que producen IL-17 independientemente de IL-23, lo que podría explicar estos resultados.
Los ensayos clínicos comparativos son cruciales en la enfermedad inflamatoria intestinal, en la que tradicionalmente se comparaban terapias con placebo. El estudio de Peyrin-Biroulet y colaboradores reveló que risankizumab no fue inferior a ustekinumab en remisión clínica a las 24 semanas (58,6% frente al 39,5%) y fue superior en remisión endoscópica a las 48 semanas (31,8% frente al 16,2%) en pacientes con enfermedad de Crohn de moderada a grave que no respondieron o tuvieron efectos adversos con la terapia anti-TNF. Aunque el ensayo fue abierto, el revisor central de endoscopia no conocía la asignación de los grupos, lo que reduce el sesgo potencial.
Si bien podría concluirse que la focalización en IL-23 p19 es más efectiva que en IL-12 p40, varios factores influyen en este resultado. La superioridad de risankizumab sobre ustekinumab podría deberse a diferencias en la penetración y localización de los fármacos en los tejidos intestinales, afinidad por sus dianas, o su interacción con las células inmunitarias. En el ensayo SEQUENCE, esta eficacia superior podría estar relacionada con un mayor papel biológico de la vía de la IL-23 entre los participantes, especialmente en aquellos con una enfermedad refractaria a la terapia anti-TNF y una duración promedio de la patología de 7,3 años.
Los estudios preclínicos han mostrado que la IL-12 y la IL-23 cumplen funciones distintas en diferentes etapas de la enfermedad, con la IL-12 siendo más relevante en las fases iniciales y la IL-23 en las etapas avanzadas. Las variaciones en las respuestas a las terapias pueden depender del fenotipo clínico, las vías biológicas involucradas, el estadio de la enfermedad y las terapias previas. Por ello, es crucial llevar a cabo más ensayos comparativos de IL-23 p19 y IL-12 p40 en diversas subpoblaciones de pacientes. Estos estudios, actualmente en curso, podrían mejorar la selección de terapias dirigidas para pacientes con enfermedad de Crohn.
Fuente bibliográfica
Interleukin-23 p19 and Interleukin-12 p40, Head-to-Head, against Gut Inflammation
Clara Abraham, M.D.
Yale University, New Haven, CT
N Engl J Med 2024;391:275-277
Temas Relacionados