
HIPERTENSIÓN / 2014 / VOL. 19
22
Mutación KCNJ5:
Mutaciones de línea germinal y se asocian a HAB en pacientes jóvenes, constituyendo una nueva
entidad denominada HAP familiar tipo III. Por otro lado existen mutaciones somáticas presentes
en el 30 – 40% de los APA. Generalmente se presenta en pacientes jóvenes y de sexo femenino.
Esta alteración aumenta la secreción de aldosterona a través de un incremento en la conductancia
del sodio a nivel de la membrana plasmática resultando en despolarización celular y activación de
los canales de calcio voltaje dependientes
(14)
.
Mutaciones ATPasa:
Identificadas por secuenciación exómica de muestras tumorales en pacientes con APA no afectados
por mutación KCNJ5 y es más frecuente en hombres. Se han descrito alteraciones a nivel de 2
genes de la familia ATPasa
(15)
:
a) ATP1A1: Se encuentra en el 5,2% de los APA. Codifica para una subunidad de la bomba Na
+
/
K
+
ATPasa correspondiendo a una mutación inactivante, ya que reduce la afinidad por el K
+
.
b) ATP2B3: Presente en 1,2% de los APA. También es una mutación inactivante a nivel Ca
++
ATPasa de la membrana plasmática, determinando un aumento de los niveles de Ca
++
intracelular.
Mutación CACNA1D:
Presente en 4,9 a 7,8% de los APA. Identificada por secuenciación exómica en regiones con
apariencia histológica glomerulosa – like
(16)
. Corresponde a una mutación activante que codifica para
una alteración a nivel de la subunidad 1
a
de canales de calcio voltaje dependiente determinando
incremento del influjo de este catión con aumento de señales intracelulares mediadas por éste y
mayor secreción de aldosterona. Su presencia determina un fenotipo más grave afectando con
más frecuencia a hombres mayores y provocando hipokalemia severa, anormalidades cardiacas
y convulsiones
(17)
.
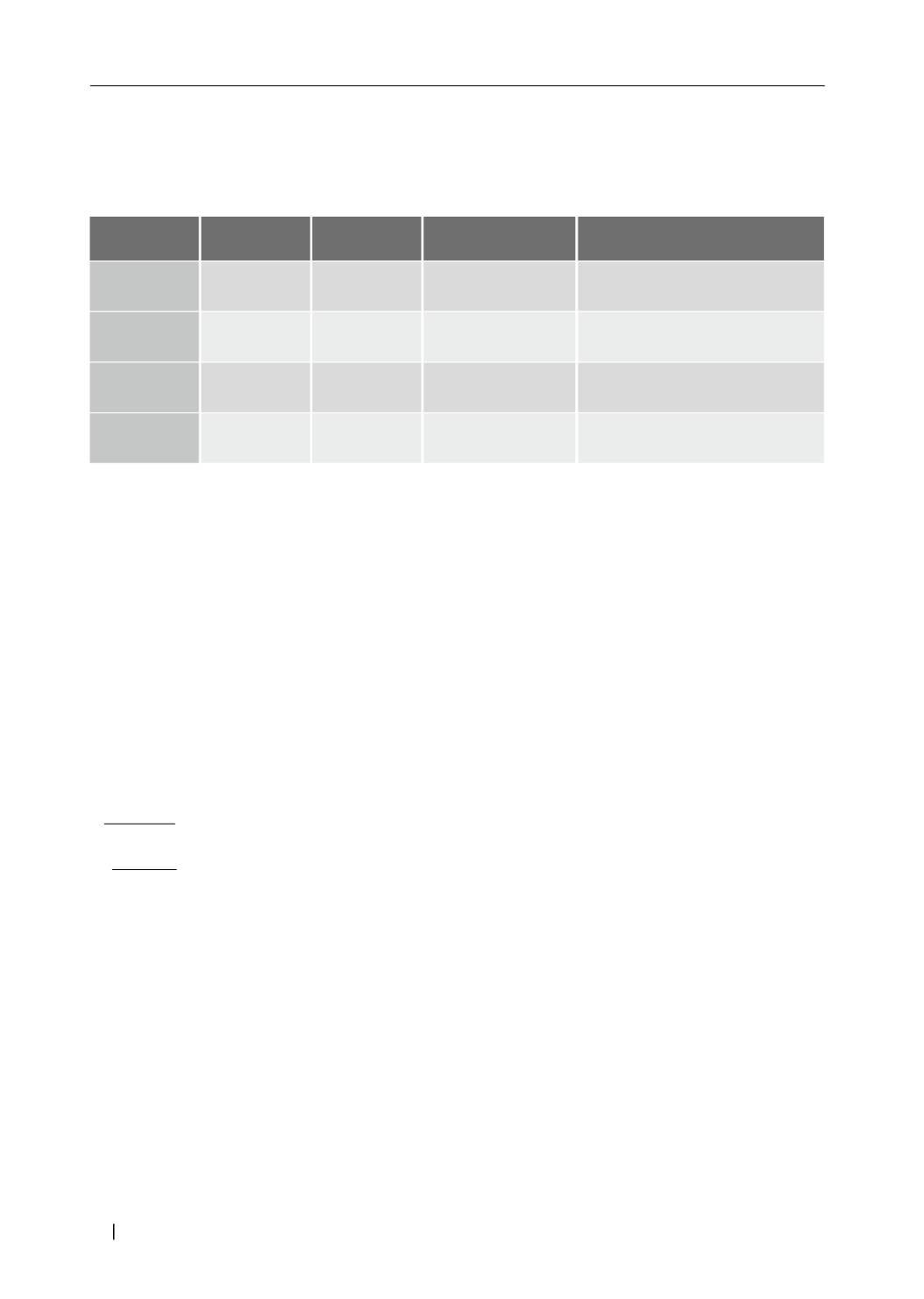
Tabla Nº2
Nuevas mutaciones en el Hiperaldosteronismo primario
Aumenta conductancia al Na
+
Reduce a nidad K
+
Reduce conductancia al Ca
++
Aumenta in ujo de Ca
+
intracelular
Efecto
Sitio afectado
Activante
Activante
Inactivante
Inactivante
Canal Na
+
/K
+
Subunidad 1
α
canales de Ca
++
voltaje dependiente
Na
+
/K
+
ATPasa
Ca
++
ATPasa
30 - 40%
1,2%
4,9 - 7,8%
5,2%
Frecuencia
en APA
Tipo
mutación
Mutación
KCNJ5
ATP2B3
CACNA1D
ATP1A1
















