
Neumol Pediatr 2015; 10 (3): 118 - 123
C o n t e n i d o d i s p o n i b l e e n h t t p : / / www. n e umo l o g i a - p e d i a t r i c a . cl
121
Neumonía por bacterias atípicas: mycoplasma y chlamydia pneumoniae
En cuanto a las técnicas serológicas por ELISA son
de fácil realización, más sensible que cultivo para infección
aguda y comparable a la reacción de polimerasa en cadena
en inmunocompetentes. La IgM se eleva luego de la primera
semana, y antecede en dos semanas la elevación de IgG;
sin embargo, pueden detectarse IgM hasta 12 meses tras la
infección aguda.
Las crioaglutininas son autoanticuerpos IgM, que
generan aglutinación de eritrocitos a 4ºC y se manifiestan en el
50% de las infecciones por
Mycoplasma pneumoniae
. Aparecen a
las dos semanas y desaparecen a las 6-8 semanas. Actualmente
están en desuso por tener baja sensibilidad y especificidad, ya
que se producen en una variada gama de infecciones como
Adenovirus y virus Epstein barr.
La reacción de polimerasa en cadena (PCR), es un
método relativamente nuevo, que busca identificar regiones
específicas del
Mycoplasma pneumoniae
(RNA ribosomal,
adhesina, p1, entre otros). Esta técnica tiene las ventajas de
que es altamente sensible, y rápida; sin embargo, al igual que el
cultivo, la correlación clínica es fundamental para interpretar un
resultado positivo como infección.
Realizar una recomendación en relación al estudio
diagnóstico de
Mycoplasma pneumoniae
es complejo. Un estudio
reciente ha comparado el uso de PCR versus serología. El
hallazgo más importante mencionado en este estudio es la gran
discordancia de resultados entre ambas pruebas, probablemente
atribuible a la persistencia serológica de la bacteria. Los autores
recomiendan el uso de ambas pruebas en forma complementaria
(13). En relación a esto nos parece que una conducta prudente
sería frente a una alta sospecha clínica de infección por
Mycoplasma, en el contexto de un paciente ambulatorio con
enfermedad leve, considerarlo como infección, sin necesidad
de realizar más test diagnósticos. Sin embargo en el caso de
un paciente hospitalizado, con mayor compromiso, utilizar las
técnicas disponibles, para lograr, junto a la evaluación clínica,
una mejor interpretación de ellas.
En relación al tratamiento de la infección por
Mycoplasma pneumoniae
la droga de elección es un macrólido,
la cual no tiene resistencia descrita y presenta la mayor
capacidad de acumulación en el espacio intracelular (14).
Entre estos, se prefiere azitromicina por su potencia y efecto
prolongado, además que permite administración una vez al día,
favoreciendo la adherencia. Sin embargo, el punto de discusión
radica en la real necesidad y los objetivos del tratamiento
farmacológico. Una revisión Cochrane que investigó la efectividad
del tratamiento antibacteriano para infección por
Mycoplasma
pneumoniae
incluyó 7 ensayos clínicos randomizados, cuya
mayor limitación es que los estudios incluían población
infectada por otros agentes infecciosos. Se observó en esta
revisión que no hubo diferencias en tratar a estos pacientes con
macrólidos versus tratar con otro antibiótico inefectivo contra
Mycoplasma pneumoniae
(generalmente amoxicilina). Sólo un
estudio mostró 100% resolución de síntomas en aquellos que
recibieron azitromicina versus 77% en aquellos tratados con
otros antibacterianos al mes de evolución. En esta revisión se
concluye que la evidencia disponible es insuficiente para realizar
una recomendación (15).
Una revisión más reciente con el mismo objetivo
incluyó 17 estudios, muestra que la diferencia de riesgo que
favorece el tratamiento no es significativa. Esta revisión menciona
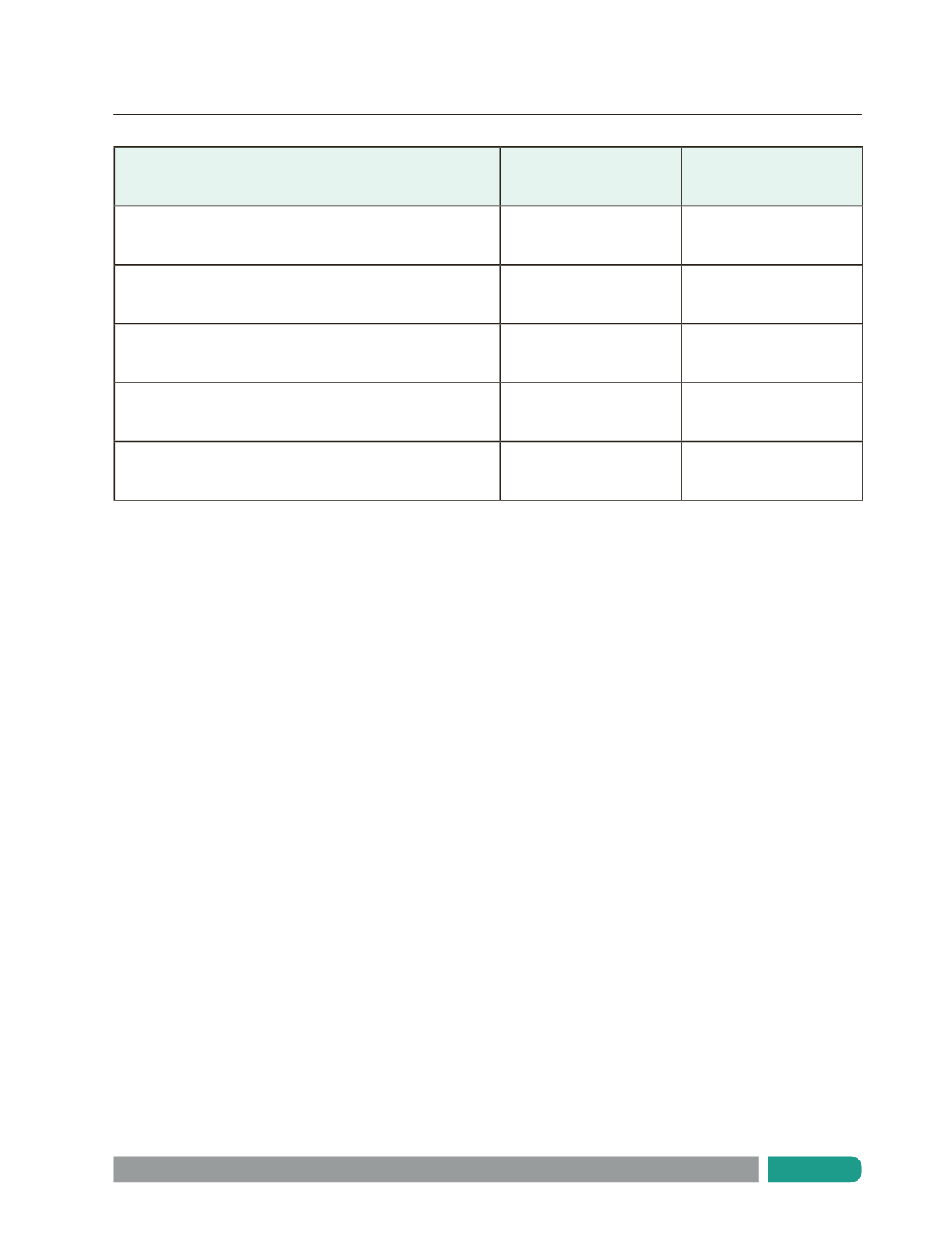
Tabla 2.
Pruebas diagnósticas para Mycoplasma pneumoniae
ELISA: enzyme-linked immunosorbent assay
PCR: polymerase chain reaction.
Prueba
Sensibilidad (%)
Especificidad (%)
Cultivo
61
100
Inmunofluorescencia indirecta
78
92
ELISA
93 – 100
79 – 100
Crioaglutininas
30 – 50
50
PCR
78- 100
92-100
















